题目内容
16.表为元素周期表的一部分.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
| 四 | ⑪ | ⑫ | ⑬ | |||||
(2)表中元素⑦的原子结构示意图为

(3)表中元素⑥⑩氢化物的稳定性顺序为HF>HCl(填写化学式,下同);
(4)表中元素⑩和⑬最高价氧化物对应水化物的酸性:HClO4>HBrO4.
(5)表中元素②和⑦最高价氧化物对应水化物的碱性NaOH>LiOH.
分析 由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl、⑪为K、⑫为Ga、⑬为Br.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;单质室温下呈液态为溴单质;
(2)⑦为Na元素,原子核外有11个电子,有3个电子层,各层电子数为2、8、1;
(3)元素非金属性越强,对应氢化物越稳定;
(4)元素非金属性越强,最高价氧化物对应水化物的碱性越强;
(5)元素金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl、⑪为K、⑫为Ga、⑬为Br.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中,非金属性最强是F元素,金属性最强是K元素;元素Br的单质室温下呈液态,
故答案为:F;K;Br;
(2)⑦为Na元素,原子核外有11个电子,有3个电子层,各层电子数为2、8、1,原子结构示意图为 ,
,
故答案为: ;
;
(3)非金属性F>Cl,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性:HF>HCl,
故答案为:HF;HCl;
(4)非金属性Cl>Br,元素非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:HClO4>HBrO4,
故答案为:HClO4;HBrO4;
(5)金属性Na>Li,元素金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>LiOH,
故答案为:NaOH>LiOH.
点评 本题考查位置、结构、性质的关系,为高频考点,把握元素的位置推断元素及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 酸性:HClO4>H2SO4 | |
| B. | Na、Mg与水反应,Na更剧烈 | |
| C. | 气态氢化物的稳定性:HF>HCl | |
| D. | 向Na2SO3溶液中加盐酸,有气泡产生 |
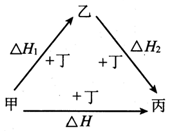 甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )
甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )| A. | S、SO3 | B. | AlCl3、NaAlO2 | C. | Na、Na2O2 | D. | NaOH、Na2CO3 |

| A. | 状态Ⅰ→状态Ⅲ是放热过程 | |
| B. | 该过程中,CO先断键形成C和O,再生成CO2 | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O2反应,生成了CO2 | |
| D. | 状态Ⅰ→状态Ⅱ表示催化剂对反应没有起作用 |
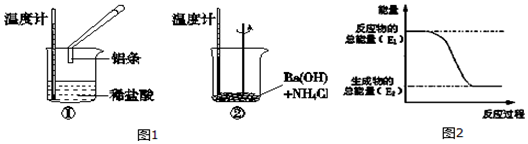

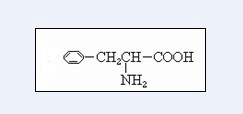 .
.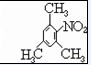 .
.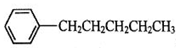 、
、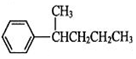 、
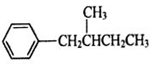
、
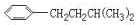 、
、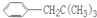 、
、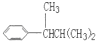 、
、 .
.