题目内容
测得某KAl(SO4)2、NaCl、Na2SO4组成的混合溶液中c(K+)=0.1mol?L-1,c(Na+)=0.2mol?L-1,c(Cl-)=0.15mol?L-1,则该溶液中c(SO42-)是( )
| A、0.1mol?L-1 |
| B、0.125mol?L-1 |
| C、0.2mol?L-1 |
| D、0.225mol?L-1 |
考点:物质的量浓度的相关计算
专题:守恒法
分析:根据溶液不显电性,则阳离子的电荷总数等于阴离子的电荷总数,即c(K+)+c(Na+)+3c(Al3+)=c(Cl-)+2c(SO42-),溶液中c(K+)=c(Al3+),以此来计算c(SO42-).
解答:
解:溶液中c(Al3+)=c(K+)=0.1mol/L,
根据溶液呈电中性,则c(K+)+c(Na+)+3c(Al3+)=c(Cl-)+2c(SO42-),
故0.1mol/L+0.2mol/L+3×0.1mol/L=0.15mol/L+2c(SO42-),
解得c(SO42-)=0.225mol/L,
故选:D.
根据溶液呈电中性,则c(K+)+c(Na+)+3c(Al3+)=c(Cl-)+2c(SO42-),
故0.1mol/L+0.2mol/L+3×0.1mol/L=0.15mol/L+2c(SO42-),
解得c(SO42-)=0.225mol/L,
故选:D.
点评:本题考查溶液物质的量浓度的计算,难度不大,注意电解质混合溶液中离子浓度计算常利用电荷守恒计算.

练习册系列答案
相关题目
下列物质中属于碱性氧化物的是( )
| A、O2 |
| B、Na2O |
| C、NaClO |
| D、SO2 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3,下列说法错误的是( )
| A、电池工作时,锌失去电子 |
| B、电池正极的电极反应式为:2MnO2+H2O+2e-=Mn2O3+2OH- |
| C、电池工作时,OH-向MnO2反应的方向移动 |
| D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
下列各组有机化合物中,肯定属于同系物的一组是( )
| A、C2H6 与C5H12 |
| B、C3H6 与C4H8 |
| C、甲醇与乙二醇 |
D、 与 与 |
防治环境污染,改善生态环境已成为全球的共识.空气质量报告的各项指标能体现空气的质量.下列各项指标不需要监测的是( )
| A、PM--2.5 |
| B、NO2浓度 |
| C、SO2浓度 |
| D、CO2浓度 |
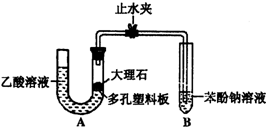 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.