题目内容
6.氨气在工农业生产中有重要应用.Ⅰ.(1)如图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象.
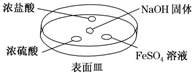
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为NH3+HCl═NH4Cl.
②FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3•H2O═Fe(OH)2↓+2NH4+和4Fe(OH)2+O2+2H2O═4Fe(OH)3.
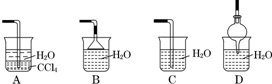
(2)已知氨气极易溶于水,而难溶于有机溶剂CCl4.下列装置中不适宜做氨气尾气吸收的是C.
Ⅱ.现代传感信息技术在化学实验中有广泛的应用

某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1).
(1)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2).图2中D点时喷泉最剧烈.
(2)从三颈瓶中量取25.00mL氨水至锥形瓶中,加入甲基橙做指示剂;用0.0500mol•L-1HCl滴定.终点时溶液颜色由黄色变为橙色,用pH计采集数据、电脑绘制滴定曲线如下图

(3)据图,计算氨水的浓度为0.0450mol•L-1;比较当VHCI=17.50ml时溶液中离子浓度大小关系c(NH4+)>c(Cl-)>c(OH-)>c(H+).
(4)关于该滴定实验的说法中,正确的是BCD.
A.锥形瓶中有少量蒸馏水导致测定结果偏低
B.酸式滴定管在滴定前有气泡,滴定后气泡消失测得氨水的浓度偏高
C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高
D.滴定终点时俯视读数会导致测得氨水的浓度偏低.
分析 Ⅰ.(1)①浓盐酸和浓氨水易挥发,浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵;
②氢氧化钠具有吸水性,溶于水并放热,滴加氨水,生成氨气,氨气与浓盐酸反应生成氯化铵,与浓硫酸反应生成硫酸铵或硫酸氢铵,氨气与硫酸亚铁溶液反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化生成氢氧化铁,以此解答;
(2)根据氨气极易溶于水,尾气吸收时要防止倒吸,导气管不能插入到液面以下以及氨气难溶于有机溶剂CCl4;
Ⅱ.(1)三颈瓶内气体与外界大气压压强之差越大,其喷泉越剧烈;
(2)氨水是弱碱,用盐酸滴定恰好反应生成氯化铵溶液,铵根离子水解显酸性,甲基橙指示剂变色范围3.1-4.4,酸中为红色,碱中为黄色,变色范围内为橙色;
可以用移液管或碱式滴定管量取碱性溶液;
(3)氨气极易溶于水,三颈瓶中氨气溶于水形成喷泉充满整个三颈瓶,氨水的物质的量浓度=$\frac{1}{{V}_{m}}$mol/L=$\frac{1}{22.4}$mol/L,当VHCI=17.50ml时,溶液PH=9,溶液显碱性,此时溶液中为氯化铵和一水合氨;
(4)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量;
B.酸式滴定管在滴定前有气泡,滴定后气泡消失,读取标准溶液体积增大;
C.酸式滴定管未用盐酸润洗会导致盐酸浓度偏低;
D.滴定终点时俯视读数会导致盐酸溶液体积偏小.
解答 解:Ⅰ.(1)①浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵,该反应为NH3+HCl═NH4Cl,故答案为:NH3+HCl═NH4Cl;
②FeSO4与碱反应生成白色沉淀,发生反应为Fe2++2NH3•H2O═Fe(OH)2↓+2NH4+,然后出现灰绿色沉淀,过一段时间后变成红褐色,是因氢氧化亚铁被氧化,发生反应为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(2)A、水的密度比四氯化碳小,浮在四氯化碳的上面,四氯化碳不能和氨气反应,也不溶解氨气,该装置既能够吸收易溶性气体,又能够防止倒吸.故A正确;
B、吸收装置中的导管下连漏斗,漏斗的边缘紧靠液面,易吸收易溶性气体,能防止倒吸,故B正确;
C、吸收装置中的导气管插入到液面,易吸收易溶性气体,但产生倒吸,故C错误;
D、吸收装置中的导管没直接伸入到液体中,而是与烧杯连接紧密,易吸收易溶性气体,能防止倒吸,故D正确;
故选:C;
Ⅱ.(1)三颈瓶内气体与外界大气压压强之差越大,其反应速率越快,D点压强最小、大气压不变,所以大气压和D点压强差最大,则喷泉越剧烈,故答案为:D;
(2)从三颈瓶中量取25.00mL氨水至锥形瓶中,加入甲基橙指示剂,在碱溶液中是黄色,PH变色范围为:3.1-4.4,用0.0500mol•L-1HCl滴定.终点时溶液颜色由黄色变化为橙色,
故答案为:甲基橙,黄,橙;
(3)氨气极易溶于水,三颈瓶中氨气溶于水形成喷泉充满整个三颈瓶,设三颈瓶体积为1L,所以氨水的物质的量浓度=$\frac{1}{{V}_{m}}$mol/L=$\frac{1}{22.4}$mol/L=0.0450mol/L,当VHCI=17.50ml时,溶液PH=9,溶液显碱性,此时溶液中为氯化铵和一水合氨,一水合氨电离大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:0.0450;c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,标准溶液浓度和待测溶液体积是恒定数值,分析操作归结为标准溶液的体积变化来判断待测溶液的浓度变化,
A.锥形瓶中有少量蒸馏水,待测溶液浓度稀释,溶质物质的量不变,对测定结果无影响,故A错误;
B.酸式滴定管在滴定前有气泡,滴定后气泡消失,消耗标准溶液盐酸的体积增大,测得氨水的浓度偏高,故B正确;
C.酸式滴定管未用盐酸润洗会导致标准溶液浓度减小,测得氨水的浓度偏高,故C正确;
D.滴定终点时俯视读数,读取标准溶液的体积会偏小,导致测得氨水的浓度偏低,故D正确;
故答案为:BCD;
点评 本题考查性质实验方案设计,侧重考查学生分析、判断及实验操作能力,明确滴定原理、喷泉实验原理、弱电解质电离等知识点是解本题关键,中和滴定的步骤和误差分析方法,题目难度中等.

 字词句段篇系列答案
字词句段篇系列答案| A. | 金属钠存放于煤油中 | |
| B. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| C. | 铝片置于广口瓶中保存 | |
| D. | 将1mol/L的NaCl溶液保存在容量瓶中 |
| A. | 氢气在氧气中燃烧 | B. | Ba(OH)2•8H2O与NH4Cl固体的反应 | ||
| C. | 铝片与稀盐酸的反应 | D. | 过氧化钠与水反应产生氧气 |
| A. | X只能是第三周期元素 | B. | a-b+n+m的和只可能等于10 | ||
| C. | b大于5 | D. | Y可能是第二周期元素 |
| A. | 2H++2e-═H2 | B. | Fe-2e-═Fe2+ | ||
| C. | 2H2O+O2+4e-═4OH- | D. | Fe+2e-═Fe2+ |
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、NO3-、CO32- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | H+,K+,OH-,NO3- |

| A. | A | B. | B | C. | C | D. | D |
