题目内容
下列溶液氯离子的物质的量浓度与50mL 2mol?L-1氯化铝溶液中氯离子的物质的量浓度相等的是( )
| A、150 mL 1 mol?L-1氯化钠溶液 |
| B、75 mL 1.5 mol?L-1氯化钙溶液 |
| C、150 mL 3 mol?L-1氯化钾溶液 |
| D、50 mL 3 mol?L-1氯化镁溶液 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:根据离子的物质的量浓度=溶质的物质的量浓度×一个溶质中含有离子的个数,与溶液的体积无关.
解答:
解:50mL 2mol?L-1AlCl3溶液中氯离子的物质的量浓度为2mol?L-1×3=6mol?L-1,
A、150 mL 1 mol?L-1NaCl溶液中Cl-浓度为1mol?L-1×1=1mol?L-1,故A错误;
B、75 mL 1.5 mol?L-1CaCl2溶液中Cl-浓度为1.5mol?L-1×2=3mol?L-1,故B错误;
C、150 mL 3 mol?L-1KCl溶液中Cl-浓度为3mol?L-1×1=3mol?L-1,故C错误;
D、50 mL 3 mol?L-1MgCl2溶液中Cl-浓度为3mol?L-1×2=6mol?L-1,故D正确;
故选D;
A、150 mL 1 mol?L-1NaCl溶液中Cl-浓度为1mol?L-1×1=1mol?L-1,故A错误;
B、75 mL 1.5 mol?L-1CaCl2溶液中Cl-浓度为1.5mol?L-1×2=3mol?L-1,故B错误;
C、150 mL 3 mol?L-1KCl溶液中Cl-浓度为3mol?L-1×1=3mol?L-1,故C错误;
D、50 mL 3 mol?L-1MgCl2溶液中Cl-浓度为3mol?L-1×2=6mol?L-1,故D正确;
故选D;
点评:本题考查物质的量浓度的大小比较,注意物质的构成,把握离子浓度与溶液浓度的关系,难度不大.

练习册系列答案
相关题目
人体血液中的pH保持在7.35~7.45,适量的CO2可维持这个pH变化范围,可用下面化学方程式表示:H2O+CO2
H2CO3
H++HCO
,人呼出的气体中CO2的体积分数约为5%.下列说法中正确的是( )
| 肺 |
| 血液 |
- 3 |
| A、太快且太深的呼吸可导致酸中毒(pH过低) |
| B、太快且太深的呼吸可导致碱中毒(pH过高) |
| C、太慢且太浅的呼吸可导致碱中毒(pH过高) |
| D、呼吸快慢或深浅不会导致酸或碱中毒 |
150℃、101kP时,由两种烃组成的混合气体0.5L在4.5LO2中完全燃烧,测得反应后气体总面积小于5L其中含CO20.8L,则生成的水蒸气体积为( )
| A、A0.7L | B、1.4L |
| C、1.6L | D、2.8L |
已知aL硫酸铝溶液中,含有27g A13+,取0.5aL硫酸铝溶液稀释至2aL,则稀释后溶液中SO42ˉ的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
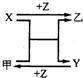 X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题:
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题: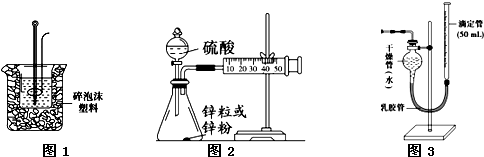
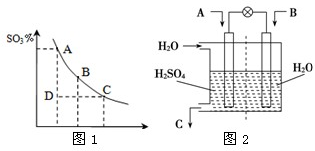 已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好.
已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好.