题目内容
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
(1)有科学家提出可利用Fe0吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)△H=-76.0KJ/moL
该反应中每放出38kJ热量,转移电子的物质的量为 .
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H<0
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的浓度如图1所示:用CH4表示达到平衡时的正反应速率 ,起始充H2的物质的量为 ,CO2的平衡转化率为 .

②图2表示H2在建立平衡过程中的速率时间图,若现在20min时缩小容器体积,并在30min时又达到状态,请在图2中画出H2的逆反应方向速率时间图象.
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图3所示:
①上述生产过程的能量转化方式是
②上述电解反应在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 .
(1)有科学家提出可利用Fe0吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)△H=-76.0KJ/moL
该反应中每放出38kJ热量,转移电子的物质的量为
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H<0
①向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的浓度如图1所示:用CH4表示达到平衡时的正反应速率

②图2表示H2在建立平衡过程中的速率时间图,若现在20min时缩小容器体积,并在30min时又达到状态,请在图2中画出H2的逆反应方向速率时间图象.
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图3所示:
①上述生产过程的能量转化方式是
②上述电解反应在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为
考点:化学平衡的计算,氧化还原反应的电子转移数目计算,常见化学电源的种类及其工作原理,化学平衡建立的过程
专题:化学平衡专题
分析:(1)依据热化学方程式定量关系计算,对应化学方程式中元素化合价变化计算电子转移,反应焓变是完全反应放出的热量;
(2)①依据化学平衡三段式列式计算,图象中读出平衡浓度,反应速率V=
,转化率
×100%计算;
②反应是气体体积减小的反应,在20min时缩小容器体积,增大压强,反应速率增大,正逆反应速率增大,正反应速率增大得到大,随反应进行减小,逆反应速率增大的小,随反应进行增大最后达到平衡状态;
(3)①依据图示可知是太阳能和电能转化为化学能的变化过程;
②上述电解反应在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应是碳酸根离子失电子生成氧气的过程,阴极是二氧化碳得到电子生成碳,依据电子守恒和传导离子配平书写电极反应.
(2)①依据化学平衡三段式列式计算,图象中读出平衡浓度,反应速率V=
| △c |
| △t |
| 消耗量 |
| 起始量 |
②反应是气体体积减小的反应,在20min时缩小容器体积,增大压强,反应速率增大,正逆反应速率增大,正反应速率增大得到大,随反应进行减小,逆反应速率增大的小,随反应进行增大最后达到平衡状态;
(3)①依据图示可知是太阳能和电能转化为化学能的变化过程;
②上述电解反应在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应是碳酸根离子失电子生成氧气的过程,阴极是二氧化碳得到电子生成碳,依据电子守恒和传导离子配平书写电极反应.
解答:
解:(1)6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)△H=-76.0KJ/moL,依据元素化合价变化分析转移电子4mol放出 76KJ,所以该反应中每放出38kJ热量,转移电子的物质的量为2mol,
故答案为:2moL;
(2)①平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L) 1.0 4.0 0 0
变化量(mol/L) 0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
用CH4表示达到平衡时的正反应速率=
=0.08 mol?L-1?min-1;
起始充H2的物质的量=4.0mol/L×2L=0.8mol;
CO2的平衡转化率=
×100%=80%
故答案为:0.08 mol?L-1?min-1;8 mol,80%;
②CO2(g)+4H2(g)?CH4(g)+2H2O(g),反应是气体体积减小的反应,在20min时缩小容器体积,增大压强,反应速率增大,正逆反应速率增大,正反应速率增大得到大,随反应进行减小,逆反应速率增大的小,随反应进行增大最后达到平衡状态,氢气的逆反应速率如右图 ;
;
故答案为: ;
;
(3)①依据图示可知是太阳能和电能转化为化学能的变化过程,故答案为:太阳能和电能转化为化学能;
②上述电解反应在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应是碳酸根离子失电子生成氧气的过程,电极反应为:2CO32--4e-═2CO2↑+O2↑,
故答案为:2CO32--4e-═2CO2↑+O2↑.
故答案为:2moL;
(2)①平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L) 1.0 4.0 0 0
变化量(mol/L) 0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
用CH4表示达到平衡时的正反应速率=
| 0.8mol/L |
| 10min |
起始充H2的物质的量=4.0mol/L×2L=0.8mol;
CO2的平衡转化率=
| 0.8mol/L |
| 1.0mol/L |
故答案为:0.08 mol?L-1?min-1;8 mol,80%;
②CO2(g)+4H2(g)?CH4(g)+2H2O(g),反应是气体体积减小的反应,在20min时缩小容器体积,增大压强,反应速率增大,正逆反应速率增大,正反应速率增大得到大,随反应进行减小,逆反应速率增大的小,随反应进行增大最后达到平衡状态,氢气的逆反应速率如右图
 ;
;故答案为:
 ;
;(3)①依据图示可知是太阳能和电能转化为化学能的变化过程,故答案为:太阳能和电能转化为化学能;
②上述电解反应在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应是碳酸根离子失电子生成氧气的过程,电极反应为:2CO32--4e-═2CO2↑+O2↑,
故答案为:2CO32--4e-═2CO2↑+O2↑.
点评:本题考查了热化学方程式定量计算,化学方程式三段式计算应用,速率图象影响因素分析判断和绘制,原电池原理的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列各对物质中,互为同系物的是( )
A、CH3-CH=CH2与 |
B、 与 与 |
| C、乙二醇和丙三醇 |
D、 与 与 |
有机物分子中原子之间(或原子与原子团之间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A、乙醇不能与NaOH溶液反应,苯酚则能跟NaOH溶液反应 |
| B、乙烷不能发生加成反应,乙烯则能够发生加成反应 |
| C、苯不能使酸性高锰酸钾溶液褪色,甲苯则能使酸性高锰酸钾溶液褪色 |
| D、苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |

 和
和 ⑥
⑥ 和
和
 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下: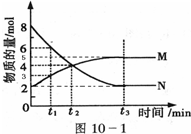 Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切? 根据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图,其中盐桥内装琼脂饱和KNO3溶液.请回答下列问题:
根据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图,其中盐桥内装琼脂饱和KNO3溶液.请回答下列问题: 下图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
下图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )