题目内容
观察下列模型并结合有关信息,判断有关说法正确的是( )
| 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl | |
| 结构模型示意图 |  |
 |
 |
 |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A、单质硼属分子晶体,其结构单元B12中含有30个B-B键,含20个正三角形 |
| B、SF6是由极性键构成的分子 |
| C、固态硫S8属于原子晶体 |
| D、NaCl熔化和溶于水均能产生自由移动的离子,且破坏的是同种作用力,NaCl晶胞中每个Na+周围最近且等距离的Na+有6个 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A.根据图中硼的结构单元解题,每个B原子具有
×5个共价键,每个三角形中含有
×3个共价键;
B、不同非金属元素的原子之间形成极性键;
C、根据晶体中存在的微粒判断;
D、氯化钠为离子化合物,NaCl晶胞中每个Na+周围最近且等距离的Na+有12个.
| 1 |
| 2 |
| 1 |
| 2 |
B、不同非金属元素的原子之间形成极性键;
C、根据晶体中存在的微粒判断;
D、氯化钠为离子化合物,NaCl晶胞中每个Na+周围最近且等距离的Na+有12个.
解答:
解:A.单质硼属于原子晶体,由图知,每个B原子具有
×5个共价键,12个B原子共含有12×
×5=30个共价键,含有的三角形数目=30÷(
)=20,故A错误;
B.不同非金属元素的原子之间形成极性键,所以SF6是由极性键构成的分子,故B正确;
C.固态S是由S8构成的,该晶体中存在的微粒是分子,所以属于分子晶体,故C错误;
D、氯化钠为离子化合物,NaCl熔化和溶于水均能产生自由移动的离子,且破坏的都是离子键,NaCl晶胞中每个Na+周围最近且等距离的Na+有12个,故D错误;
故选B.
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
B.不同非金属元素的原子之间形成极性键,所以SF6是由极性键构成的分子,故B正确;
C.固态S是由S8构成的,该晶体中存在的微粒是分子,所以属于分子晶体,故C错误;
D、氯化钠为离子化合物,NaCl熔化和溶于水均能产生自由移动的离子,且破坏的都是离子键,NaCl晶胞中每个Na+周围最近且等距离的Na+有12个,故D错误;
故选B.
点评:本题考查微粒的结构示意图(比例、球棍模型、电子式、结构式、原子结构示意简图),难点是选项A,注意根据均摊法进行分析解答即可,题目难度中等.

练习册系列答案
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
与NH4+具有相同电子总数和质子总数的是( )
| A、Na+ |
| B、F- |
| C、Ne |
| D、K+ |
下列表示物质结构的化学用语或模型正确的是( )
A、对硝基甲苯的结构简式: |
B、CH4分子的球棍模型: |
C、醛基的电子式: |
| D、葡萄糖的最简式(实验式):CH2O |
下列反应类型:①酯化、②取代、③消去、④加成、⑤水解、⑥还原,可能在有机物分子中引入羟基的是( )
| A、①②③⑥ | B、②④⑤ |
| C、②④⑤⑥ | D、②④⑥ |
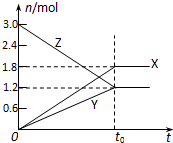 在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,t0时容器中达到化学平衡,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,t0时容器中达到化学平衡,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z?3X+2Y |
| B、达到平衡时,X、Y、Z的质量不再改变 |
| C、达到平衡时,Z的浓度为1.2mol/L |
| D、达到平衡后,反应停止,反应速率为0 |
下列化学用语正确的是( )
A、NH4H的电子式: |
| B、硬脂酸的分子式为:C17H35COOH |
C、基态Mg原子的核外电子轨道表示式: |
| D、Cr元素的外围电子排布式:3d54S1 |
下列说法正确的是( )
A、高聚物脲醛树脂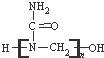 的合成单体之一是CH3OH 的合成单体之一是CH3OH |
B、按系统命名法,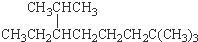 的名称为2,7,7-三甲基-3-乙基辛烷 的名称为2,7,7-三甲基-3-乙基辛烷 |
| C、有一种信息素的结构简式为CH3(CH2)5CH═CH(CH2)9CHO,为验证该物质中既含有醛基又含有碳碳双键,向该物质的试液中先加溴的CCl4溶液,观察到溶液褪色,继续滴加直到溶液变为红棕色,再向溶液中加入0.5mL H2O,充分振荡,观察到溶液褪色 |
D、化合物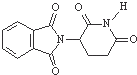 的分子式为C13H8O4N2 的分子式为C13H8O4N2 |
下列说法正确的是( )
| A、纸层析法分离铁离子和铜离子的实验中,应沿试管壁小心地将展开剂慢慢倒入试管底部 |
| B、硫酸铜溶液中加入过量浓氨水,最终溶液中出现大量淡蓝色絮状沉淀 |
| C、在氯化铝溶液中分别加入过量的氢氧化钠溶液和浓氨水,均可形成铝的配合物Al(OH)4- |
| D、在盛有氯化钴溶液的试管中,加入一定量的浓盐酸,溶液的颜色由粉红色变为蓝色 |