题目内容
10.用含Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O.工艺流程如下: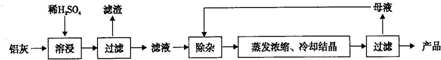
(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(2)检验滤液中还存在Fe2+的方法是取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
Ⅰ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3.2;
Ⅱ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅲ.加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的是将Fe2+氧化为Fe3+;调节溶液的pH为3.2的目的是调节pH值使铁元素沉淀完全.
②向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是有黄绿色气体生成.
③Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式).
分析 铝灰(含Al2O3及少量SiO2和FeO•xFe2O3),加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,滤渣为二氧化硅和不溶性杂质,滤液中加入稍过量的高锰酸钾溶液氧化亚铁离子为铁离子,调节溶液PH使铁离子全部沉淀,铝离子不沉淀,加入适量硫酸锰除去过量的高锰酸钾过滤得到二氧化锰固体和氢氧化铁沉淀,滤液主要是硫酸铝溶液,蒸发浓缩,冷却结晶过滤洗涤得到硫酸铝晶体,
(1)氧化铝是两性氧化物溶于强酸强碱,与硫酸反应生成硫酸铝和水;
(2)亚铁离子、铁离子同时存在,可用酸性高锰酸钾溶液检验亚铁离子;
(3)一定条件下,MnO4-可与Mn2+反应生成MnO2;
①依据金属阳离子沉淀开始和完全沉淀需要的溶液pH分析,亚铁离子被氧化为铁离子,调节溶液pH使铁离子全部沉淀;
②浓盐酸和二氧化锰再加热条件下生成黄绿色气体氯气;
③加入MnSO4至紫红色消失,目的是除去过量高锰酸根离子;
(4)由元素守恒可知,母液中存在较多的K+、SO42-.
解答 解:向铝灰中加入过量稀H2SO4,A12O3和少量FeO•xFe2O3和硫酸反应生成硫酸铝、硫酸铁、硫酸亚铁,SiO2不反应,过滤除去二氧化硅;向滤液中加入过量KMnO4溶液,高锰酸钾把亚铁离子氧化成铁离子,调节溶液的pH约为3.7生成氢氧化铁沉淀,除去铁离子,过滤,滤液中含铝离子和过量的高锰酸根离子,加入硫酸锰把过量高锰酸根离子除去,再过滤,对滤液蒸发浓缩、结晶分离出硫酸铝晶体,
(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;
(2)由于铁离子和亚铁离子同时存在,所以检验亚铁离子应该用酸性高锰酸钾溶液,方法为:取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色,
故答案为:取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色;
(3)①向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子;
依据图表数据分析可知,铁离子开始沉淀和沉淀完全的溶液PH为2.7~3.2,铝离子和亚铁离子开始沉淀的溶液pH大于3.2,所以调节溶液的pH约为3.2,可以使铁离子全部沉淀,铝离子不沉淀分离,
故答案为:将Fe2+氧化为Fe3+;调节pH值使铁元素沉淀完全;
②向Ⅱ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,生成氯化锰、氯气和水,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2的现象是生成黄绿色气体,
故答案为:有黄绿色气体生成;
③MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去,
故答案为:除去过量的MnO4-;
(4)反应后,溶液中存在较多的K+、SO42-便留在母液中,可回收的主要物质为K2SO4,
故答案为:K2SO4.
点评 本题考查了物质的制备流程分析,题目难度中等,涉及铝、铁及其化合物性质的应用,主要是混合物分离的方法和实验设计,加入氧化剂氧化亚铁离子,调节溶液PH是沉淀分离是解题的关键,试题充分考查了学生的分析、理解能力及化学实验能力.

| A. | 稀盐酸加入大理石中:CO32-+2H+═H2O+CO2↑ | |
| B. | 氢氧化钡溶液中加入稀硫酸SO42-+Ba2+═BaSO4↓ | |
| C. | 硫酸溶液加入Cu(OH)2中:2H++Cu(OH)2═Cu2++2H2O | |
| D. | 稀盐酸加入铁粉中:2Fe+6H+═2Fe3++3H2↑ |

| A. | 电极a在装置中做正极 | |
| B. | 装置中膜A是阳离子交换膜 | |
| C. | 电极b的电极反应式是2NO3-+10e-+12H+═N2↑+6H2O | |
| D. | 若有机物表示为C4H8O2,每转移10mol电子,电极a上产生22.4LCO2(标准状况) |
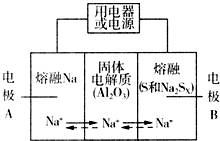 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$2Na+XS (3<X<5)
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100℃~300℃
C.300℃~350℃D.350℃~2050℃
(5)关于钠硫电池,下列说法正确的是AD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(6)25℃时,若用钠硫电池作为电源电解500mL 0.2mol•L-1 NaCl溶液,当溶液的pH变为l3时(忽略电解前后溶液的体积变化),电路中通过的电子的物质的量为
0.05mol,钠硫电池两极的反应物的质量差为2.3 g.(假设电解前钠硫电池两极的反应物质量相等)
| A. | O.1mol/LKHC03溶液与O.1mol/L KOH溶液等体积混合,所得溶液中:c(K+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 20ml O.lmol/L CH3COONa溶液与lOmLO.lmol/L HCl溶液混合后溶液呈酸性,所得溶液中:C(Cl-)>(CH3COO-)>c(H+)>c(CH3COOH) | |
| D. | pH=2的H2C2O4溶液与pH=l2的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| C. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 | |
| D. | 浓硫酸可用来干燥H2S、CO、Cl2等气体 |

 .
. .
. ②
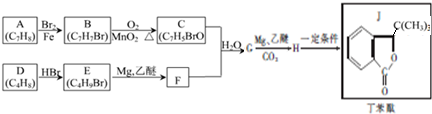
② 中氯原子在水溶液中不水解,写出2-氯甲苯(
中氯原子在水溶液中不水解,写出2-氯甲苯( )经两步反应合成A的化学方程式.
)经两步反应合成A的化学方程式. ,
, 合成A时产生的有机副产物可能是
合成A时产生的有机副产物可能是 、
、 .
.
 .
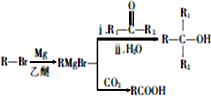
.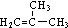 +HBr→(CH3)3CBr.
+HBr→(CH3)3CBr.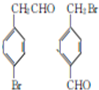 .
.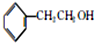 )
) .
.