题目内容
2.0.1mol•L-1HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )| A. | c(H+)>c(F-) | B. | c(H+)>c(HF) | C. | c(OH-)<c(HF) | D. | c(HF)>c(F-) |
分析 0.1mol•L-1HF溶液的pH=2,氢离子浓度为0.01mol/L,说明HF为弱酸,在溶液中部分电离,根据物料守恒c(HF)+c(F-)=0.1mol/L可知,c(HF)≈0.09mol/L,结合电荷守恒进行判断.
解答 解:0.1mol•L-1HF溶液的pH=2,氢离子浓度为0.01mol/L,
A.HF溶液中存在电荷守恒:c(H+)=c(OH-)+c(F-),则c(H+)>c(F-),故A正确;
B.该溶液中c(H+)=0.01mol/L,由于水的电离程度较小,则c(H+)≈c(F-),根据物料守恒c(HF)+c(F-)=0.1mol/L可知,c(HF)≈0.09mol/L,所以c(H+)<c(HF),故B错误;
C.HF为酸溶液,溶液中氢氧根离子浓度非常小,则c(OH-)<c(HF),故C正确;
D.根据B可知,c(F-)≈c(H+)=0.01mol/L,c(HF)≈0.09mol/L,则c(HF)>c(F-),故D正确;
故选B.
点评 本题考查了离子浓度大小比较,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析、理解能力.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
13.同一主族的两种元素的核外电子差值不可能为( )
| A. | 2 | B. | 8 | C. | 18 | D. | 30 |
10.将木炭与浓硫酸共热后得到的过量气体通入下列溶液中不会得到无色澄清溶液的是( )
| A. | 稀品红溶液 | B. | Ca(OH)2溶液 | C. | 溴水 | D. | 饱和H2S溶液 |
17.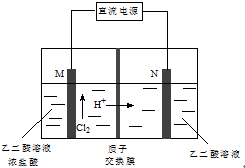 乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )
 乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )| A. | M极与直流电源的负极相连 | |
| B. | 若有2 molH+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol | |
| C. | N电极上的电极反应式:HOOC-COOH-2e-+2H+=HOOC-CHO+H2O | |
| D. | 乙二醛与M电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O=HOOC-CHO+2HCl |
12.在溶液中加入足量的Na2O2后仍能大量共存的离子组是( )
| A. | Na+、Fe2+、Cl-、SO42- | B. | K+、[Al(OH)4]-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO${\;}_{3}^{-}$ | D. | Na+、Cl-、CO32-、SO32- |

 )为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.
)为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.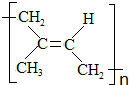 .
.