题目内容
15.某学生在实验室制Cl2时可能进行如下操作:①连接好装置,检查气密性;
②缓缓加热;
③加入MnO2粉末;
④从装有浓盐酸的分液漏斗中向烧瓶里滴加浓盐酸;
⑤多余的Cl2用NaOH溶液吸收;
⑥用向上排空气法收集Cl2.
其中正确的操作顺序是( )
| A. | ①②③④⑤⑥ | B. | ③④②①⑥⑤ | C. | ①④③②⑥⑤ | D. | ①③④②⑥⑤ |
分析 制取气体实验中各操作过程为:连接仪器,把实验室的单个仪器组装成制取装置;检查气密性,防止装置连接处漏气,氯气有毒会污染大气;加入药品,先向烧瓶中装入二氧化锰、再分液漏斗中加入浓盐酸,接下来,反应需要加热时开始加热;待气体均匀放出时开始收集气体:氯气密度大于空气,采用向上排空气法收集;氯气有毒,需要进行尾气吸收,据此对各操作进行排序.
解答 解:实验室用二氧化锰与浓盐酸加热反应正确氯气,制取氯气的正确操作步骤为:先连接装置、检查气密性,然后装入药品:先向烧瓶中装入二氧化锰,再向分液漏斗中装入浓盐酸,下一步进行加热制取、收集氯气,由于氯气有毒,最后需要进行尾气吸收,所以正确的操作顺序是:①③④②⑥⑤,
故选:D.
点评 本题考查了实验室制备氯气的操作步骤,掌握实验室中制取气体的方法和步骤,掌握实验室制取氯气的反应原理及正确的操作步骤是解答此题的基础和关键,题目难度不大.

练习册系列答案
相关题目
11.如图是某有机物分子的球棍模型,该物质中含C、H、O三种元素.则该物质不具有的性质是( )

| A. | 使紫色石蕊试液变红 | B. | 易溶于水 | ||
| C. | 发生酯化反应 | D. | 无色无味 |
6.下列各组物质均能发生加成反应的是( )
| A. | 乙烯和溴乙烷 | B. | 溴苯和环己烷 | C. | 苯和乙醛 | D. | 丙烯和乙醇 |
3.有机物X和Y可作为“分子伞”给药物载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)
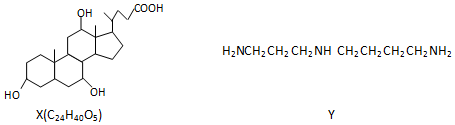
下列叙述错误的是( )
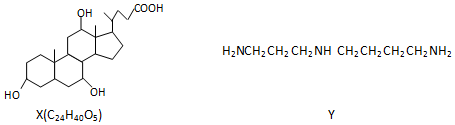
下列叙述错误的是( )
| A. | 1molX在浓硫酸作用下发生消去反应,最多生成3molH2O | |
| B. | 1molY发生类似酯化的反应,最多消耗2molX | |
| C. | X与足量HBr反应,所得有机物的分子式为C24H37O2Br3 | |
| D. | Y与癸烷的分子链均呈锯齿形,但Y的极性较强 |
20.卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是( )
| A. | 卤素单质的熔点按F2、Cl2、Br2、I2的顺序依次减小 | |
| B. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 | |
| C. | 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 | |
| D. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 |
7.下列关于氯的说法正确的是(NA表示阿伏伽德罗常数)( )
| A. | 1molCl2与NaOH溶液完全反应,转移电子数为2NA | |
| B. | 100g36.5%的盐酸中含HCl分子为NA | |
| C. | 1.12LCl2含有1.7NA个质子 | |
| D. | 56gFe与足量的Cl2完全反应,消耗Cl2分子数为1.5NA |
13.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)?Ni(CO)4(g).230℃时,该反应的平衡常数K=2×10-5.已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应.
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍.
下列判断正确的是( )
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍.
下列判断正确的是( )
| A. | 增加c(CO),平衡向正向移动,反应的平衡常数增大 | |
| B. | 第二阶段,Ni(CO)4分解率较低 | |
| C. | 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ | |
| D. | 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) |
