题目内容
11.氯化铁水解的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,加热该溶液,蒸干并灼烧得到Fe2O3,(填化学式)分析 在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3和盐酸,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼热氢氧化铁分解生成氧化铁;
解答 解:在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3,水解的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼热发生2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,使Fe(OH)3分解生成Fe2O3,
故答案为:Fe3++3H2O?Fe(OH)3+3H+,Fe2O3.
点评 本题考查盐类的水解,题目难度不大,注意水解平衡移动的影响因素,注意加热蒸发灼烧后的产物判断.

练习册系列答案
相关题目
9.国际纯粹与应用化学联合会在1989年作出决定:把元素周期表原先的主、副族号取消,由左到右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列.按这个规定,下列说法正确的是( )
| A. | 第3列元素种类最多,第14列元素形成的化合物种类最多 | |
| B. | 每一列都有非金属元素 | |
| C. | 从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
19.图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法正确的是( )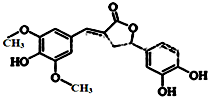

| A. | 分子中含有三种官能团 | |
| B. | 1 mol 该化合物最多能与6 mol NaOH 反应 | |
| C. | 1 mol 该化合物最多能与含4 molBr2的浓溴水反应 | |
| D. | 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2 |
16.在无色透明强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Ca2+、HCO3-、SO42- | B. | Cl-、NO3-、Fe2+、K+ | ||
| C. | Na+、OH-、MnO4-、Ba2+ | D. | K+、Mg2+、NO3-、SO42- |
20.菜谱中记载:河虾不宜与西红柿同食.主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷.下列说法不正确的是( )
| A. | 五价砷在维生素C作用下发生了还原反应 | |
| B. | “两者同食”发生的反应中维生素C作还原剂 | |
| C. | 河虾中含有的五价砷,没有毒性 | |
| D. | 毒药砒霜是含砷的氧化物,可以推测砒霜中所含的砷元素化合价为+5 |
1.下列各选项的变化中,不能通过置换反应实现的是( )
| A. | CO2→MgO | B. | Fe3O4→H2O | C. | FeCl3→CuCl2 | D. | MnO2→Al2O3 |
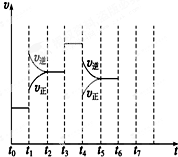 在一密闭容器中发生反应N2+3H22NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
在一密闭容器中发生反应N2+3H22NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题: .
.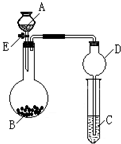 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题: