题目内容
13.常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可与氢气反应生成烷,一般认为加氢反应是在催化剂表面进行.反应过程的示意图如下:

下列说法中正确的是( )
| A. | 乙烯和H2生成乙烷的反应△H>0 | |
| B. | 加入催化剂,降低了E活,并减小了反应的△H | |
| C. | 图1表明,催化加氢过程中催化剂参与反应过程并形成不稳定的中间体 | |
| D. | 图2表明,催化加氢过程中催化剂将较难发生的反应分成了多个容易发生的反应,可提高反应物的转化率 |
分析 A.由图可知乙烯和H2生成乙烷的反应为放热反应;
B.加入催化剂,反应热不变;
C.由图可知加入催化剂降低反应的活化能,应生成不稳定的中间体;
D.催化剂不影响平衡移动.
解答 解:A.由图可知乙烯和H2生成乙烷的反应为放热反应,则△H<0,故A错误;
B.由图可知加入催化剂,反应物与生成物的总能量差不变,则反应热不变,故B错误;
C.由图可知加入催化剂降低反应的活化能,应生成不稳定的中间体,可知催化剂参加反应,故C正确;
D.催化剂不影响平衡移动,不能改变转化率,故D错误.
故选C.
点评 本题考查学生反应热的判断、催化剂的特点等知识,为高频考点,侧重考查学生的分析能力,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2?2SO3,这是一步正反应放热的可逆反应.如果反应在密闭容器中进行,下列有关说法中错误的是( )
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 在上述条件下,SO2不可能100%地转化为SO3 | |
| C. | 为了提高SO2的转化率,应适当提高O2的浓度 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
1.下列溶液中各微粒的浓度关系不正确的是( )
| A. | 0.1 mol•L-1的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| B. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| C. | 0.1 mol•L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
8.下列说法正确的是( )
| A. | 按系统命名法,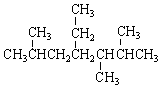 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 肌醇 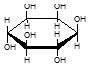 与葡萄糖 与葡萄糖 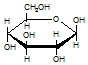 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的 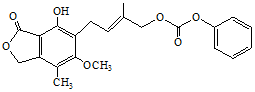 最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 |
18.固体硝酸盐加热易分解且产物较复杂.某学习小组以AgNO3为研究对象,拟通过实验探究其热分解的产物,提出如下3种猜想:
甲:Ag2O、NO2、O2乙:Ag、NO2、O2 丙:Ag2O、NO2、N2
(1)实验前,小组成员经讨论认定猜想丙不成立,理由是不符合氧化还原反应原理.
查阅资料得知:
2NO2+2NaOH═NaNO3+NaNO2+H2O;Ag2O与粉末态的Ag均为黑色;Ag2O可溶于氨水.针对甲、乙猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,首先进行的操作是检验装置的气密性.
②将AgNO3固体置于A中,加热前通入N2以驱尽装置内的空气,其目的是避免对产物O2检验产生干扰;关闭K,用酒精灯加热时,正确操作是先移动酒精灯预热硬质玻璃管,然后固定在管中固体部位下加热.
③观察到A 中有红棕色气体出现,C、D 中有气泡.
④待样品完全分解,A 装置冷却至室温.
⑤取少量剩余固体于试管中,加入适量水,未见明显现象.
(3)实验结果分析讨论
①证明一定有O2生成的依据是C中的溶液不褪色,且D中的溶液褪色,与此相关的化学原理为Na2SO3+H2O?NaHSO3+NaOH、2Na2SO3+O2═2Na2SO4(用化学方程式表示).
②针对试管中残留黑色固体的成分,该学习小组进行了如下探究:
【提出假设】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
【实验评价】根据上述实验,不能确定固体产物成分的实验是b(填实验编号).
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
(4)从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进?有,应在AB装置间增加防倒吸的装置.
甲:Ag2O、NO2、O2乙:Ag、NO2、O2 丙:Ag2O、NO2、N2
(1)实验前,小组成员经讨论认定猜想丙不成立,理由是不符合氧化还原反应原理.
查阅资料得知:
2NO2+2NaOH═NaNO3+NaNO2+H2O;Ag2O与粉末态的Ag均为黑色;Ag2O可溶于氨水.针对甲、乙猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,首先进行的操作是检验装置的气密性.
②将AgNO3固体置于A中,加热前通入N2以驱尽装置内的空气,其目的是避免对产物O2检验产生干扰;关闭K,用酒精灯加热时,正确操作是先移动酒精灯预热硬质玻璃管,然后固定在管中固体部位下加热.
③观察到A 中有红棕色气体出现,C、D 中有气泡.
④待样品完全分解,A 装置冷却至室温.
⑤取少量剩余固体于试管中,加入适量水,未见明显现象.
(3)实验结果分析讨论
①证明一定有O2生成的依据是C中的溶液不褪色,且D中的溶液褪色,与此相关的化学原理为Na2SO3+H2O?NaHSO3+NaOH、2Na2SO3+O2═2Na2SO4(用化学方程式表示).
②针对试管中残留黑色固体的成分,该学习小组进行了如下探究:
【提出假设】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
(4)从实验安全的角度判断该实验装置有无缺陷?若有,应如何改进?有,应在AB装置间增加防倒吸的装置.
5.利用图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )

| A. | 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 外加电流的阴极保护法中,X是待保护金属 |
5.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤.下列图示装置和原理能达到实验目的是( )
| A. | 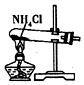 制取氧气 | B. | 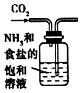 制取NaHCO | C. | 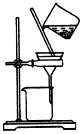 分离NaHCO3 | D. | 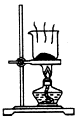 干燥NaHCO |
6.下列叙述正确的是( )
| A. |  和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| B. |  和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香族化合物 既是芳香烃又是芳香族化合物 | |
| C. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| D. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有5种 |
 CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题:
CuSO4和Cu(NO3)2是自然界中重要的铜盐.请回答下列问题: (用箭头表示出配位键的位置)
(用箭头表示出配位键的位置)