题目内容
5.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤.下列图示装置和原理能达到实验目的是( )| A. | 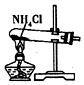 制取氧气 | B. | 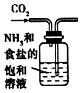 制取NaHCO | C. | 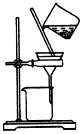 分离NaHCO3 | D. | 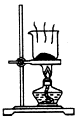 干燥NaHCO |
分析 A.氯化铵不稳定,加热易分解,温度稍低又可生成氯化铵;
B.气体通入方向错误;
C.从溶液中分离碳酸氢钠固体,可用过滤的方法;
D.碳酸氢钠不稳定,不能直接加热干燥.
解答 解:A.氯化铵不稳定,加热易分解,温度稍低又可生成氯化铵,制备氨气,应用氯化铵和氢氧化钙为反应物,故A错误;
B.应将二氧化碳从长导管进入,否则将液体排出,故B错误;
C.从溶液中分离碳酸氢钠固体,可用过滤的方法,故C正确;
D.碳酸氢钠不稳定,不能直接加热干燥,可烘干,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的分离、提纯以及制备,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
18.化学与生产、生活、社会可持续发展密切相关.下列说法正确的是( )
| A. | 推广使用一次性木筷,减少疾病传染 | |
| B. | 将地沟油回收重新加工为食用油,提高资源的利用率 | |
| C. | 推广使用电动汽车、天然气汽车等公共交通工具,保护环境 | |
| D. | 推广使用煤的气化、液化技术可减少二氧化碳等温室气体的排放 |
13.常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可与氢气反应生成烷,
一般认为加氢反应是在催化剂表面进行.反应过程的示意图如下:

下列说法中正确的是( )
一般认为加氢反应是在催化剂表面进行.反应过程的示意图如下:

下列说法中正确的是( )
| A. | 乙烯和H2生成乙烷的反应△H>0 | |
| B. | 加入催化剂,降低了E活,并减小了反应的△H | |
| C. | 图1表明,催化加氢过程中催化剂参与反应过程并形成不稳定的中间体 | |
| D. | 图2表明,催化加氢过程中催化剂将较难发生的反应分成了多个容易发生的反应,可提高反应物的转化率 |
10. 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 稀硫酸 | Na[Al(OH)4]溶液 |
| B | 稀硝酸 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
17.中学化学常见物质A、B、C、D、X、Y,存在如图转化关系(部分物质和条件略去)请根据要求回答下列问题:

(1)若A为NaOH溶液,X为CO2,D是沉淀,①则Y可为BD(填序号).
A.SO3 B.Ba(OH)2 C.H2SO4 D.CaO
②A可与C反应生成B的离子方程式为HCO3-+OH-=CO32-+H2O.
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,A与D反应生成一种化肥,
①实验室制备气体A的反应、收集和尾气处理装置如图依次为ACG.用此装置制备A的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.

②写出木炭与D的浓溶液在加热的条件下发生反应的化学方程式4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+4NO2↑.
(3)若A和X均为单质,反应Ⅲ的现象是白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,
①检验B溶液中是否存在C的试剂可选用C(填序号).
A.Cl2 B.NaOH溶液 C.酸性KMnO4 D.KSCN溶液
②C溶液在贮存时应加入少量X,其理由是(用离子方程式说明)2Fe3++Fe=3Fe2+.
(4)若A金属,D为强碱,则:
①写出A与水反应生成D的离子方程式2Na+2H2O=2Na++2OH-+2H2↑.
②反应Ⅲ中,还原剂是Na2O2.
(5)若A为淡黄色固体单质,D是强酸,
①把一定量的锌与100mL 18.5mol•L-1的D充分反应后,锌完全溶解,同时生成气体M 33.6L(标准状况).将反应后的溶液稀释到1L后溶液的c(H+)=0.1mol•L-1,则下列叙述不正确的是B.
②为了分离气体M,并分别得到干燥的气体,某学生设计了如图实验装置,a、b为活塞,且每个装置中的溶液均过量.甲容器中盛C;乙容器中盛A(填字母).
A.浓硫酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钡溶液

气体M实验时,关闭b,打开a,此时分离出的气体是H2;当分离完一种气体后,关闭a,打开b,此时得到的气体是SO2.

(1)若A为NaOH溶液,X为CO2,D是沉淀,①则Y可为BD(填序号).
A.SO3 B.Ba(OH)2 C.H2SO4 D.CaO
②A可与C反应生成B的离子方程式为HCO3-+OH-=CO32-+H2O.
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,A与D反应生成一种化肥,
①实验室制备气体A的反应、收集和尾气处理装置如图依次为ACG.用此装置制备A的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.

②写出木炭与D的浓溶液在加热的条件下发生反应的化学方程式4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+4NO2↑.
(3)若A和X均为单质,反应Ⅲ的现象是白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,
①检验B溶液中是否存在C的试剂可选用C(填序号).
A.Cl2 B.NaOH溶液 C.酸性KMnO4 D.KSCN溶液
②C溶液在贮存时应加入少量X,其理由是(用离子方程式说明)2Fe3++Fe=3Fe2+.
(4)若A金属,D为强碱,则:
①写出A与水反应生成D的离子方程式2Na+2H2O=2Na++2OH-+2H2↑.
②反应Ⅲ中,还原剂是Na2O2.
(5)若A为淡黄色固体单质,D是强酸,
①把一定量的锌与100mL 18.5mol•L-1的D充分反应后,锌完全溶解,同时生成气体M 33.6L(标准状况).将反应后的溶液稀释到1L后溶液的c(H+)=0.1mol•L-1,则下列叙述不正确的是B.
| A.气体M是SO2和H2的混合物 | B.气体M是SO2和H2的体积比为4:1 |
| C.反应中共消耗锌97.5g | D.反应中共转移电子3mol |
A.浓硫酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钡溶液

气体M实验时,关闭b,打开a,此时分离出的气体是H2;当分离完一种气体后,关闭a,打开b,此时得到的气体是SO2.
10.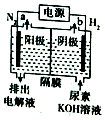 用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )
用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )
 用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )
用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )| A. | 尿素由碳、氮、氧、氢四种元素组成的有机化合物 | |
| B. | 尿素在阳极被氧化,当生成1 mol N2时,转移电子为6 mol | |
| C. | a、b两处生成的气体体积比为1:3 | |
| D. | 假设电解过程中溶液体积不变,电解后排出液的pH比通入前大 |
14. 向甲乙两个容积均为1L的恒容容器中,分别充入2moLA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
向甲乙两个容积均为1L的恒容容器中,分别充入2moLA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
 向甲乙两个容积均为1L的恒容容器中,分别充入2moLA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
向甲乙两个容积均为1L的恒容容器中,分别充入2moLA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )| A. | X可能等于2也可能等于3 | |
| B. | 向平衡后的乙容器中充入氦气可使c(A)增大 | |
| C. | 向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol•L-1<c(A)<1.56mol•L-1 | |
| D. | 将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同 |
