题目内容
8.下列说法正确的是( )| A. | 按系统命名法,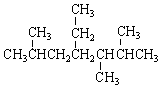 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 肌醇 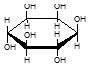 与葡萄糖 与葡萄糖 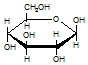 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的 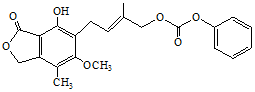 最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 |
分析 A.未满足取代基位次之和最小,主链编号错误;
B.烷烃同分异构体中支链越多,沸点越低;
C、肌醇为环己六醇属于环醇类,葡萄糖是多羟基醛或酮;
D、酚-OH、-COOC能与NaOH溶液反应.
解答 解:A.主链含有7个碳为庚烷,从右端编号,化合物的名称应是2,3,5-三甲基-4-乙基庚烷,故A错误;
B.烷烃同分异构体中支链越多,沸点越低,则正戊烷、异戊烷、新戊烷的沸点依次降低,故B错误;
C、肌醇为环己六醇属于环醇类,葡萄糖是多羟基醛或酮,故C错误;
D、分子中含有1个酚羟基、3个酯基,都能与NaOH反应,其中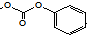 能和3molNaOH反应,则1mol该有机物最多能和含5molNaOH的水溶液完全反应,故D正确;
能和3molNaOH反应,则1mol该有机物最多能和含5molNaOH的水溶液完全反应,故D正确;
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,为解答该类题目的关键,题目难度中等.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
4.氰气[(CN)2]和氰化物都是剧毒性物质,氰分子的结构式为N≡C-C≡N,性质与卤素相似,下列叙述错误的是( )
| A. | 氰分子中四原子共直线,是非极性分子 | |
| B. | 氰分子中C≡N键长大于C≡C键长 | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰化氢在一定条件下能与烯烃发生加成反应 |
5.Q、W、X、Y、Z是原子序数依次增大的短周期元素,Q和Y均满足主族序数与周期序数相等,Q与X、W与Z同主族,Q和W能形成原子个数之比为1:1和2:1的常见无机化合物.下列说法不正确的是( )
| A. | 简单离子半径:Z>W>X>Y | |
| B. | W、X形成的化合物中一定含有离子键 | |
| C. | 最简单氢化物的还原性:Z>W | |
| D. | 工业上常用电解熔融氯化物的方法制备X、Y的单质 |
3.设NA为阿伏伽德罗常数值.下列有关叙述不正确的是( )
| A. | 1molCnH2n-2(n≥2)中所含的共用电子对数为(3n+l)NA | |
| B. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子 转移的数目为5NA | |
| C. | 60 克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 5.8 g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA |
13.常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可与氢气反应生成烷,
一般认为加氢反应是在催化剂表面进行.反应过程的示意图如下:

下列说法中正确的是( )
一般认为加氢反应是在催化剂表面进行.反应过程的示意图如下:

下列说法中正确的是( )
| A. | 乙烯和H2生成乙烷的反应△H>0 | |
| B. | 加入催化剂,降低了E活,并减小了反应的△H | |
| C. | 图1表明,催化加氢过程中催化剂参与反应过程并形成不稳定的中间体 | |
| D. | 图2表明,催化加氢过程中催化剂将较难发生的反应分成了多个容易发生的反应,可提高反应物的转化率 |
20.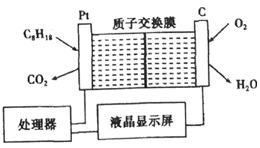 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式为:C8H18+16H2O-50e-═8CO2+50H+ | |
| C. | 每消耗标准状况下5.6 L O2溶液中通过lmol 电子 | |
| D. | H+由质子交换膜左侧向右侧迁移 |
17.中学化学常见物质A、B、C、D、X、Y,存在如图转化关系(部分物质和条件略去)请根据要求回答下列问题:

(1)若A为NaOH溶液,X为CO2,D是沉淀,①则Y可为BD(填序号).
A.SO3 B.Ba(OH)2 C.H2SO4 D.CaO
②A可与C反应生成B的离子方程式为HCO3-+OH-=CO32-+H2O.
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,A与D反应生成一种化肥,
①实验室制备气体A的反应、收集和尾气处理装置如图依次为ACG.用此装置制备A的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.

②写出木炭与D的浓溶液在加热的条件下发生反应的化学方程式4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+4NO2↑.
(3)若A和X均为单质,反应Ⅲ的现象是白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,
①检验B溶液中是否存在C的试剂可选用C(填序号).
A.Cl2 B.NaOH溶液 C.酸性KMnO4 D.KSCN溶液
②C溶液在贮存时应加入少量X,其理由是(用离子方程式说明)2Fe3++Fe=3Fe2+.
(4)若A金属,D为强碱,则:
①写出A与水反应生成D的离子方程式2Na+2H2O=2Na++2OH-+2H2↑.
②反应Ⅲ中,还原剂是Na2O2.
(5)若A为淡黄色固体单质,D是强酸,
①把一定量的锌与100mL 18.5mol•L-1的D充分反应后,锌完全溶解,同时生成气体M 33.6L(标准状况).将反应后的溶液稀释到1L后溶液的c(H+)=0.1mol•L-1,则下列叙述不正确的是B.
②为了分离气体M,并分别得到干燥的气体,某学生设计了如图实验装置,a、b为活塞,且每个装置中的溶液均过量.甲容器中盛C;乙容器中盛A(填字母).
A.浓硫酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钡溶液

气体M实验时,关闭b,打开a,此时分离出的气体是H2;当分离完一种气体后,关闭a,打开b,此时得到的气体是SO2.

(1)若A为NaOH溶液,X为CO2,D是沉淀,①则Y可为BD(填序号).
A.SO3 B.Ba(OH)2 C.H2SO4 D.CaO
②A可与C反应生成B的离子方程式为HCO3-+OH-=CO32-+H2O.
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,A与D反应生成一种化肥,
①实验室制备气体A的反应、收集和尾气处理装置如图依次为ACG.用此装置制备A的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.

②写出木炭与D的浓溶液在加热的条件下发生反应的化学方程式4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+4NO2↑.
(3)若A和X均为单质,反应Ⅲ的现象是白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,
①检验B溶液中是否存在C的试剂可选用C(填序号).
A.Cl2 B.NaOH溶液 C.酸性KMnO4 D.KSCN溶液
②C溶液在贮存时应加入少量X,其理由是(用离子方程式说明)2Fe3++Fe=3Fe2+.
(4)若A金属,D为强碱,则:
①写出A与水反应生成D的离子方程式2Na+2H2O=2Na++2OH-+2H2↑.
②反应Ⅲ中,还原剂是Na2O2.
(5)若A为淡黄色固体单质,D是强酸,
①把一定量的锌与100mL 18.5mol•L-1的D充分反应后,锌完全溶解,同时生成气体M 33.6L(标准状况).将反应后的溶液稀释到1L后溶液的c(H+)=0.1mol•L-1,则下列叙述不正确的是B.
| A.气体M是SO2和H2的混合物 | B.气体M是SO2和H2的体积比为4:1 |
| C.反应中共消耗锌97.5g | D.反应中共转移电子3mol |
A.浓硫酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钡溶液

气体M实验时,关闭b,打开a,此时分离出的气体是H2;当分离完一种气体后,关闭a,打开b,此时得到的气体是SO2.

 为该转化过程的催化剂
为该转化过程的催化剂 ,已被广泛应用于声、热、光的传感等方面.它是由HC≡CH、(CN)2、CH3COOH 三种单体通过适宜的反应形成的.由H的结构式分析合成过程中发生反应的类型有( )
,已被广泛应用于声、热、光的传感等方面.它是由HC≡CH、(CN)2、CH3COOH 三种单体通过适宜的反应形成的.由H的结构式分析合成过程中发生反应的类型有( )