题目内容
 能源问题是当代社会面临的重大课题,甲醇是未来的重要能源物质.合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g).
能源问题是当代社会面临的重大课题,甲醇是未来的重要能源物质.合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g).请回答下列问题:
(1)如图是某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线,则该反应的△H
(2)在一定温度下,向一个容积不变的密闭容器中通入2.5molCO和7.5mol H2,达到平衡时CO的转化率为90%,则此时容器内的压强为开始时的
(3)保持和(2)相同的条件,将起始时各物质改为a mol CO、b mol H2、c mol CH3OH,若欲使平衡状态与(2)的相同,则a、b应满足的关系为
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据温度对化学平衡的影响来判断反应的吸放热情况,根据外条件对反应速率和产率的综合考虑来选择外界条件;
(2)根据化学反应前后压强之比等于物质的量之比来计算;
(3)各组成与原平衡相同说明为等效平衡,恒温恒容,前后气体体积变化,按化学计量数转化到左边,满足对于物质的物质的量相等即可;
计算出平衡时CH3OH(g)的物质的量,c大于此值平衡向逆反应进行.按化学计量数转化到左边,得到2.5mol CO时c的值最大.
(2)根据化学反应前后压强之比等于物质的量之比来计算;
(3)各组成与原平衡相同说明为等效平衡,恒温恒容,前后气体体积变化,按化学计量数转化到左边,满足对于物质的物质的量相等即可;
计算出平衡时CH3OH(g)的物质的量,c大于此值平衡向逆反应进行.按化学计量数转化到左边,得到2.5mol CO时c的值最大.
解答:
解:(1)根据图示信息,当达到化学平衡以后(甲醇含量的最高点),升高温度,甲醇的体积分数减小,说明平衡逆向移动,所以该反应是一个放热反应,高压、催化剂利用合成氨,工业上合成甲醇的适宜条件为一定温度和高压、催化剂,
故答案为:<;高压、催化剂;
(2)根据题意得到:CO(g)+2H2(g)?CH3OH(g)
初始物质的量(mol) 2.5 7.5 0
变化的物质的量(mol) 2.25 4.5 2.25
平衡的物质的量 (mol)0.25 3 2.25
所以此时容器内的压强和开始时的比值为(0.25+3+2.25):( 2.5+7.5)=0.55,
故答案为:0.55;
(3)各组成与原平衡相同说明为等效平衡,恒温恒容,前后气体体积变化,按化学计量数转化到左边,满足对于物质的物质的量相等即可.所以有 a+c=2.5,b+2c=7.5,解得2a+2.5=b.
对于反应 CO(g)+2H2(g)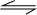 CH3OH(g);
CH3OH(g);
开始(mol):2.5 7.5 0
变化(mol):2.25 4.5 2.25
平衡(mol):0.25 3 2.25
平衡时CH3OH的物质的量为2.25mol,所以c>2.25mol平衡向逆反应进行.按化学计量数转化到左边,得到2.5mol CO时c的值最大.所以c最大为2.5mol.所以2.25<c≤2.5.
故答案为:2a+2.5=b;2.25<c≤2.5.
故答案为:<;高压、催化剂;
(2)根据题意得到:CO(g)+2H2(g)?CH3OH(g)
初始物质的量(mol) 2.5 7.5 0
变化的物质的量(mol) 2.25 4.5 2.25
平衡的物质的量 (mol)0.25 3 2.25
所以此时容器内的压强和开始时的比值为(0.25+3+2.25):( 2.5+7.5)=0.55,
故答案为:0.55;
(3)各组成与原平衡相同说明为等效平衡,恒温恒容,前后气体体积变化,按化学计量数转化到左边,满足对于物质的物质的量相等即可.所以有 a+c=2.5,b+2c=7.5,解得2a+2.5=b.
对于反应 CO(g)+2H2(g)
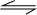 CH3OH(g);
CH3OH(g);开始(mol):2.5 7.5 0
变化(mol):2.25 4.5 2.25
平衡(mol):0.25 3 2.25
平衡时CH3OH的物质的量为2.25mol,所以c>2.25mol平衡向逆反应进行.按化学计量数转化到左边,得到2.5mol CO时c的值最大.所以c最大为2.5mol.所以2.25<c≤2.5.
故答案为:2a+2.5=b;2.25<c≤2.5.
点评:本题考查平衡计算、等效平衡等,难度较大,注意等效思想的运用以及运用极限方法确定c的取值范围.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用下图所示实验装置进行相应实验,能达到实验目的是( )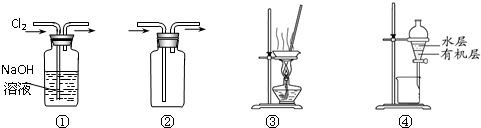

| A、装置①可用于除去Cl2中含有的少量HCl气体 |
| B、按装置②所示的气流方向可用于收集H2、NH3等 |
| C、用图③所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| D、用图④所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
下列反应的离子方程式正确的是( )
| A、向酸化的FeSO4中加入H2O2溶液:2Fe2++2H++H2O2═2Fe3++2H2O |
| B、向NaHCO3溶液中加入足量Ba(OH)2的溶液:Ba2++2HCO3-+2OH-═2H2O+BaCO3↓+CO32- |
| C、向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O═2C6H5OH+CO32- |
| D、向NaOH溶液中滴加少量氯化铝溶液:Al(OH)3+3OH-═Al(OH)3↓ |
常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )


| A、a点所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| B、b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) |
| C、d点所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
NaOH(s)、P2O5(s)、CaCl2(s)可归为一类.下列最适宜与这三种物质归为一类的是( )
| A、CaO(s) |
| B、CuO(s) |
| C、H2SO4(浓) |
| D、NaCl(s) |

 钠跟水反应的过程如图所示,试写出该反应的化学方程式:
钠跟水反应的过程如图所示,试写出该反应的化学方程式: