题目内容
13.已知铜与稀硝酸反应的化学方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O现将9.60g的铜单质加入到过量的8.40%的稀硝酸中,充分反应后,试求:(1)标准状况下生成NO多少L?
(2)这些铜单质能与多少g上述稀硝酸恰好完全反应?
(3)反应中有多少molHNO3被还原?
分析 n(Cu)=$\frac{9.6g}{64g/mol}$=0.15mol,硝酸过量,则Cu完全反应,结合3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O及V=nVm、m=nM计算.
解答 解:n(Cu)=$\frac{9.6g}{64g/mol}$=0.15mol,硝酸过量,则Cu完全反应,
(1)由3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O可知,生成NO的体积为0.15mol×$\frac{2}{3}$×22.4L/mol=2.24L,
答:标准状况下生成NO为2.24L;
(2)由3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O可知,完全反应需要的硝酸为0.15mol×$\frac{8}{3}$×63g/mol=25.2g,硝酸溶液的质量为$\frac{25.2g}{8.40%}$=300g,
答:这些铜单质能与300g上述稀硝酸恰好完全反应;
(3)由电子守恒可知,被还原的硝酸为$\frac{0.15mol×(2-0)}{(5-2)}$=0.100mol,答:反应中有0.100molHNO3被还原.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中的物质的量关系、电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
8.56Fe和56Fe2+相比较,相同的是( )
| A. | 微粒半径 | B. | 化学性质 | C. | 最外层电子数 | D. | 中子数 |
1.用如图装置能达到有关实验目的是( )
| A. |  电解精炼铝 | B. | 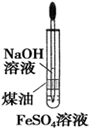 制备Fe(OH)3 | ||
| C. | 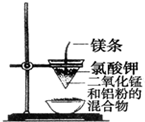 可制得金属锰 | D. | 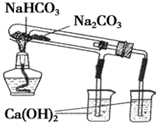 验证NaHCO3和Na2CO3的热稳定性 |
8.X、Y是元素周期表中ⅦA族的两种元素.下列叙述中能说明X的非金属性比Y的强的是( )
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的含氧酸比Y的含氧酸酸性强 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能从NaX溶液中置换出X单质 |
5.经催化加氢后,不能得到2-甲基戊烷的是( )
| A. | CH3CH═CHCH(CH3)2 | B. | (CH3)2C═CHCH2CH3 | ||
| C. | CH3CH═C(CH3)CH2CH3 | D. | CH2═CH CH2CH(CH3)2 |
2.下列关于有机物的说法正确的是( )
| A. | 乙烯、甲苯、甲烷分子中的所有原子都在同一平面上 | |
| B. | 除去乙烷中的乙烯时,通入氢气并加催化剂加热 | |
| C. | C3H8的二氯代物共有3种 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |