题目内容
7.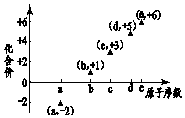 图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )| A. | 31d和33d互为同素异形体 | B. | 气态氢化物的稳定性:a>d>e | ||
| C. | 工业上常用电解法制备单质b和c | D. | a和b形成的化合物不可能含共价键 |
分析 短周期元素中,a为-2价、e为+6价,处于VI族,可推知a为O、e为S,b有+1价,原子序数大于氧,则b为Na,由原子序数可知c、d处于第三周期,化合价分别为+3、+5,则c为Al、d为P,以此解答该题.
解答 解:A.31d和33d质子数相同,中子数不同,是不同的核素,互为同位素,故A错误;
B.非金属性a(O)>e(S)>d(P),故氢化物稳定性:a>e>d,故B错误;
C.工业上电解熔融氯化钠冶炼钠,电解熔融氧化铝冶炼铝,故C正确;
D.a和b形成的化合物过氧化钠,含有共价键,故D错误,
故选C.
点评 本题考查结构性质位置关系应用,为高频考点,侧重考查学生的分析能力,根据化合价与原子序数推断元素是解题关键,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
相关题目
13.常温下,0.1mol•L-1某一元酸(HA)溶液的pH=3.下列叙述不正确的是( )
| A. | HA是一种弱酸 | |
| B. | 0.1 mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-) | |
| C. | 体积、浓度均相等的HA溶液与盐酸溶液分别与足量锌反应,产生氢气质量相同 | |
| D. | 该HA溶液中:2c(H+)=c(OH-)+c(A-)+c(HA) |
18.下列仪器通常不用于物质分离的是( )
| A. |  | B. |  | C. |  | D. |  |
15.工业上以铝土矿(主要成分Al2O3•3H2O)为原料生产铝,主要包括下列过程:
ⅰ.将粉碎、筛选、湿磨后的铝土矿浸泡在氢氧化钠溶液中,过滤;
ⅱ.通入过量二氧化碳使ⅰ所得滤液中析出氢氧化铝固体,过滤;
ⅲ.使ⅱ中所得氢氧化铝脱水生成氧化铝;
ⅳ.电解熔融氧化铝生成铝.
下列说法正确的是( )
ⅰ.将粉碎、筛选、湿磨后的铝土矿浸泡在氢氧化钠溶液中,过滤;
ⅱ.通入过量二氧化碳使ⅰ所得滤液中析出氢氧化铝固体,过滤;
ⅲ.使ⅱ中所得氢氧化铝脱水生成氧化铝;
ⅳ.电解熔融氧化铝生成铝.
下列说法正确的是( )
| A. | 过程ⅰ说明氧化铝具有酸性氧化物的性质 | |
| B. | 过程ⅱ说明碳酸的酸性比氢氧化铝的酸性弱 | |
| C. | 过程ⅲ发生的反应类型属于氧化还原反应 | |
| D. | 过程ⅳ也可以用加热法代替电解法冶炼铝 |
12.利用催化技术可将汽车尾气中的NO和CO,反应如下:2NO+2CO?2CO2+N2某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如表,下列说法中不正确的是( )
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2s内的平均反应速率υ(CO2)=3.75×10-4mol•L-1•s-1 | |
| B. | 使用催化剂可以提高单位时间内CO和NO的处理量 | |
| C. | 若将容积缩小为原来的一半,CO平衡转化率大于25% | |
| D. | 若温度降低,该反应的平衡常数增大,则该反应的△H>0 |
19.下列化学用语不正确的是( )
| A. | 羟基电子式: | B. | 甲醛的结构式: | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 1,3-丁二烯的分子式:C4H8 |
16.用CCl4提取碘水中碘的装置如图所示,下列说法不正确的是( )


| A. | 实验过程包括:萃取、分液 | |
| B. | 右图下层为CCl4层,呈紫色 | |
| C. | 用酒精也能够提取碘水中的碘 | |
| D. | 用汽油洗涤洒在衣物上的油汤也是一种萃取 |