题目内容
15.工业上以铝土矿(主要成分Al2O3•3H2O)为原料生产铝,主要包括下列过程:ⅰ.将粉碎、筛选、湿磨后的铝土矿浸泡在氢氧化钠溶液中,过滤;
ⅱ.通入过量二氧化碳使ⅰ所得滤液中析出氢氧化铝固体,过滤;
ⅲ.使ⅱ中所得氢氧化铝脱水生成氧化铝;
ⅳ.电解熔融氧化铝生成铝.
下列说法正确的是( )
| A. | 过程ⅰ说明氧化铝具有酸性氧化物的性质 | |
| B. | 过程ⅱ说明碳酸的酸性比氢氧化铝的酸性弱 | |
| C. | 过程ⅲ发生的反应类型属于氧化还原反应 | |
| D. | 过程ⅳ也可以用加热法代替电解法冶炼铝 |
分析 A、氧化铝与氢氧化钠反应生成盐与水;
B、强酸制弱酸,分析解答;
C、氢氧化铝分解生成氧化铝和水,无元素化合价的变化;
D、适合用电解法冶炼的金属为活泼金属,常见有Na、Mg、Al等;
解答 解:A、氧化铝与氢氧化钠反应生成偏铝酸钠与水,所以是酸性氧化物,故A正确;
B、过量二氧化碳与偏铝酸钠生成氢氧化铝固体,所以二氧化碳的酸性强氢氧化铝,故B错误;
C、氢氧化铝分解生成氧化铝和水,是非氧化还原的分解反应,故C错误;
D、适合用电解法冶炼的金属为活泼金属,常见有Na、Mg、Al等,铝是活泼金属不能用加热法,故D错误;
故选A.
点评 本题综合考查物质的分离、提纯的应用,为高频考点,涉及铝的化合物的性质、常用化学用语的书写等,侧重于学生的分析,难度中等,清楚实验流程、原理是解题的关键,是对知识迁移的综合运用.

练习册系列答案
相关题目
1.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 证明溶液中一定含有SO32- | 将该溶液与稀盐酸反应产生的气体通入澄清石灰水,有白色沉淀生成 |
| B | 证明氯气中混有氯化氢气体 | 将该混合气体通入AgNO3溶液中,有白色沉淀生成 |
| C | 证明某固体中有Na+,无K+ | 灼烧该固体,火焰呈黄色 |
| D | 证明Br-还原性强于Cl- | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 |
| A. | A | B. | B | C. | C | D. | D |
6.在含有较多NH4+、Ba2+、NO3- C1-的溶液中还能大量共存的离子是( )
| A. | Ag+ | B. | Mg2+ | C. | S042- | D. | OH- |
3.化学在生活中有着广泛的应用,下列对应关系错误的是( )
| 选项 | 性质 | 实际应用 |
| A | 氧化铝的熔点高 | 作耐火材料 |
| B | 铁比铜金属活动性强 | 氯化铁溶液腐蚀铜刻制印刷电路板 |
| C | 硅胶多孔,吸水强 | 作袋装食品的干燥剂 |
| D | 金属化合物灼烧有特殊颜色 | 作节日燃放的烟花 |
| A. | A | B. | B | C. | C | D. | D |
20.玉米芯与稀硫酸在加热加压下反应,可以制得糠醛(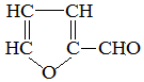 ),糠醛是重要的化工原料,用途广泛.关于糠醛的说法,不正确的是( )
),糠醛是重要的化工原料,用途广泛.关于糠醛的说法,不正确的是( )
 ),糠醛是重要的化工原料,用途广泛.关于糠醛的说法,不正确的是( )
),糠醛是重要的化工原料,用途广泛.关于糠醛的说法,不正确的是( )| A. | 其核磁共振氢谱有3种不同类型的吸收峰 | |
| B. | 1 mol糠醛可与3 mol H2 发生加成反应 | |
| C. | 可与新制的Cu(OH)2浊液在加热时反应生成红色沉淀 | |
| D. | 与苯酚在一定条件下反应得到结构简式为 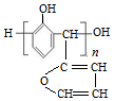 的产物 的产物 |
7.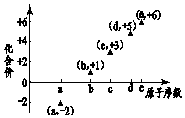 图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
 图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )| A. | 31d和33d互为同素异形体 | B. | 气态氢化物的稳定性:a>d>e | ||
| C. | 工业上常用电解法制备单质b和c | D. | a和b形成的化合物不可能含共价键 |
4.由CH2=CH2制备HO-CH2-CH2-OH,所发生的化学反应类型是( )
| A. | 加成反应、取代反应 | B. | 加成反应、消去反应 | ||
| C. | 氧化反应、加成反应 | D. | 消去反应、氧化反应 |
5.下列有关Na2CO3和NaHCO3性质的说法中,正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 相同温度下,在水中的溶解度:Na2CO3<NaHCO3 | |
| C. | 等质量的Na2CO3和NaHCO3最多产生CO2的量:Na2CO3<NaHCO3 | |
| D. | 等物质的量的Na2CO3和NaHCO3最多消耗盐酸的量:Na2CO3<NaHCO3 |
