题目内容
14.日常所用干电池其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2氧化吸收H2),电极反应可简化为:Zn-2e-═Zn2+、2NH4++2e-═2NH3+H2(NH3再用于结合Zn2+)根据上述叙述判断下列说法中正确的是( )| A. | 干电池中Zn为正极,碳为负极 | |
| B. | 干电池可以实现化学能向电能的转化和电能向化学能的转化 | |
| C. | 干电池长时间连续使用时内装糊状物可能流出腐蚀电器 | |
| D. | 干电池工作时,电子由碳极经外电路流向Zn极 |
分析 A、干电池中较活泼的金属作负极,较不活泼的导电的非金属作正极;
B、干电池是一次电池;
C、根据糊状物的性质分析,NH4Cl和ZnCl2都是强酸弱碱盐水解呈酸性;
D、干电池工作时,电子从负极经外电路流向正极.
解答 解:A、干电池中较活泼的金属锌作负极,较不活泼的导电的非金属碳作正极,故A错误;
B、干电池是一次电池,所以不能实现电能向化学能的转化,故B错误;
C、NH4Cl和ZnCl2都是强酸弱碱盐水解呈酸性,所以干电池长时间连续使用时内装糊状物可能流出腐蚀电器,故C正确;
D、干电池工作时,电流由正极碳经外电路流向负极锌,电子由Zn极经外电路流向炭极,故D错误.
故选C.
点评 本题考查了干电池的工作原理,难度不大,明确干电池和蓄电池的区别是解题的关键.

练习册系列答案
相关题目
17.表1是元素周期表的一部分:
表1
表2
25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL浓度均为0.1000mol/L 的两种酸HX、HZ(忽略体积变化),实验数据如表2,下列判断正确的是( )
表1
| 氧 | X |
| Y | Z |
| 数据编号 | 滴入NaOH溶液的体积/mL | 溶液pH | |
| HX | HZ | ||
| ① | 0 | 3 | 1 |
| ② | 20.00 | a | 7 |
| A. | 表格中a<7 | |
| B. | HX和HZ等体积混合后pH=1+lg2 | |
| C. | Y和Z两元素的简单氢化物受热分解,前者分解温度高 | |
| D. | 0.l000 mol/L Na2Y的水溶液中:c(Y2-)+c(HY-)+c(H2Y)=0.1000 mol/L |
18.用下列实验方案及所选玻璃仪器(非玻璃仪器任选)就能实现相应实验目的是( )
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去KNO3中少量NaC1 | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
| B | 证明HClO 和CH3COOH的酸性强弱 | 同温下,用pH试纸定浓度均为0.1mol•L-1的NaClO溶液和CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中水加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
| D | 配制1L1.6%的CuSO4溶液(溶液密度近似为1g/mL) | 将25g CuSO4•5H2O溶解在975g水中 | 烧杯、玻璃棒、胶头滴管、量筒 |
| A. | A | B. | B | C. | C | D. | D |
2.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数.下列说法正确的是( )
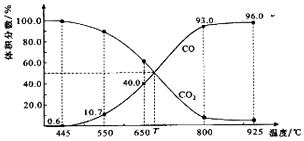

| A. | 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0P总 |
9.如图,四种装置中所盛的溶液体积均为500mL,浓度均为0.6molL-1,(③可以实现铁表面镀锌)工作一段时间后,测得导线上均通过了0.2mol电子,此时溶液中的pH由大到小的顺序是( )

| A. | ④②①③ | B. | ④③①② | C. | ④③②① | D. | ①③②④ |
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.8 g D2O含有NA个中子 | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 5.35 g NH4Cl固体中含有N-H键的个数为0.4NA | |
| D. | 常温下将0.1 mol Fe投入足量的浓硝酸中,转移的电子数为0.3NA |
6.下列微粒中,含有孤对电子的是( )
| A. | SiH4 | B. | NH4+ | C. | CH4 | D. | H2O |
3.下列离子方程式正确的是( )
| A. | 向Na[Al(OH)4]溶液中通入足量CO2:2[Al(OH)4]-+CO2═2Al(OH)3↓+CO32-+H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O |
18.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 14g 分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| B. | Na2O2与H2O的反应中每生成0.1molO2,转移电子数目为0.4NA | |
| C. | 常温常压下,1.7g NH3所含电子数为0.8NA | |
| D. | 标准状况下,11.2L NO与11.2LO2混合,原子总数小于2NA |