题目内容
下列事实能说明碳酸的酸性比乙酸弱的是( )
| A、乙酸能发生酯化反应,而碳酸不能 |
| B、碳酸和乙酸都能与碱反应,产物都是弱碱性的盐 |
| C、乙酸易溶于水,在水中的溶解度较大,而碳酸的溶解度较小 |
| D、醋酸可用于清除水垢 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:只要醋酸和碳酸盐反应能生成二氧化碳就能说明碳酸的酸性小于醋酸,据此分析解答.
解答:
解:A.乙酸能发生酯化反应说明乙酸含有羧基,与酸性强弱无关,故A错误;
B.碳酸和乙酸都能与碱反应,产物都是弱碱性的盐,说明碳酸和乙酸都是弱酸,但不能比较二者酸性强弱,故B错误;
C.酸性强弱与酸的溶解度大小无关,故C错误;
D.水垢的主要成分是碳酸钙,醋酸和碳酸钙反应生成可溶性的醋酸钙,为强酸制备弱酸,酸性乙酸较强,故D正确;
故选D.
B.碳酸和乙酸都能与碱反应,产物都是弱碱性的盐,说明碳酸和乙酸都是弱酸,但不能比较二者酸性强弱,故B错误;
C.酸性强弱与酸的溶解度大小无关,故C错误;
D.水垢的主要成分是碳酸钙,醋酸和碳酸钙反应生成可溶性的醋酸钙,为强酸制备弱酸,酸性乙酸较强,故D正确;
故选D.
点评:本题考查了酸性强弱判断,根据强酸制取弱酸分析解答即可,注意酸的强弱与酸的稳定性强弱、酸的溶解度大小无关,与其电离程度有关.

练习册系列答案
相关题目
完成下列实验所选择的装置或仪器正确的是( )
A、 构成锌铜原电池 |
B、 测定酸碱中和反应中和热大小的量热计 |
C、 验证CaO和水反应的热效应 |
D、 证明电解食盐水时阳极有Cl2,阴极有NaOH生成 |
实验室用NaCl固体配400mL 1.0mol/L NaCl溶液,下列判断不对的是( )
| A、用托盘天平称取NaCl固体23.4g |
| B、应选用500mL的容量瓶来配制此溶液 |
| C、在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D、加蒸馏水至离刻度线1-2cm时改用胶头滴管定容 |
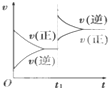 对达到平衡状态的可逆反应:A+B?C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是( )
对达到平衡状态的可逆反应:A+B?C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是( )| A、A、B、C是气体,D不是气体 |
| B、A、B是气体,C、D有一种是气体 |
| C、C、D是气体,A、B有一种是气体 |
| D、A、B、C、D都是气体 |
下列有关反应的叙述正确的是( )
| A、铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
| B、NH3+H3O+═NH4++H2O说明结合H+的能力:H2O>NH3 |
| C、FeCl2、Fe(OH)3均可通过化合反应制得 |
| D、分子式为C2H4O2的化合物只能电离,不能水解 |
 实验室需要0.80mol?L-1 NaOH溶液475mL和0.40mol?L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.80mol?L-1 NaOH溶液475mL和0.40mol?L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题: