题目内容
下列有关反应的叙述正确的是( )
| A、铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
| B、NH3+H3O+═NH4++H2O说明结合H+的能力:H2O>NH3 |
| C、FeCl2、Fe(OH)3均可通过化合反应制得 |
| D、分子式为C2H4O2的化合物只能电离,不能水解 |
考点:铝的化学性质,弱电解质在水溶液中的电离平衡,铁的氧化物和氢氧化物
专题:电离平衡与溶液的pH专题,元素及其化合物
分析:A.Al与氧气反应生成氧化铝;
B.氨气结合氢离子;
C.Fe与氯化铁反应生成氯化亚铁,氢氧化亚铁、氧气、水反应生成氢氧化铁;
D.分子式为C2H4O2的化合物,可能为乙酸,也可能为甲酸甲酯.
B.氨气结合氢离子;
C.Fe与氯化铁反应生成氯化亚铁,氢氧化亚铁、氧气、水反应生成氢氧化铁;
D.分子式为C2H4O2的化合物,可能为乙酸,也可能为甲酸甲酯.
解答:
解:A.Al与氧气反应生成氧化铝,氧化铝的熔点高,铝箔在空气中受热熔化,并不滴落,故A错误;
B.NH3+H3O+═NH4++H2O中,氨气结合氢离子,说明结合H+的能力:NH3>H2O,故B错误;
C.Fe与氯化铁反应生成氯化亚铁,氢氧化亚铁、氧气、水反应生成氢氧化铁,则均利用化合反应制备,故C正确;
D.分子式为C2H4O2的化合物,可能为乙酸,也可能为甲酸甲酯,若为乙酸可电离,若为酯可水解,故D错误;
故选C.
B.NH3+H3O+═NH4++H2O中,氨气结合氢离子,说明结合H+的能力:NH3>H2O,故B错误;
C.Fe与氯化铁反应生成氯化亚铁,氢氧化亚铁、氧气、水反应生成氢氧化铁,则均利用化合反应制备,故C正确;
D.分子式为C2H4O2的化合物,可能为乙酸,也可能为甲酸甲酯,若为乙酸可电离,若为酯可水解,故D错误;
故选C.
点评:本题考查较综合,涉及物质的性质、弱电解质的电离及同分异构体等,注重高频考点的考查,注意发生的反应,题目难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
实验是研究化学的基础,下图中所示的实验方法、装置、操作或标签正确的是( )
A、 称量 |
B、 装有酒精的试剂瓶上要有危险标志 |
C、 赶去碱式滴定管中的气泡 赶去碱式滴定管中的气泡 |
D、 石油的分馏(部分装置) |
下列同组中的两种物质,属于官能团异构的是( )
| A、CH3CH2CH2OH和 CH3CH(OH)CH3 |
| B、CH3 CH(CH3)2和 CH3 CH2CH2CH3 |
| C、CH3CH2CHO和 CH3COCH3 |
| D、CH2=CHCH2CH2CH3和CH3CH2CH=CHCH3 |
某苯的衍生物只含有两个互为对位的取代基,其分子式为C9H12O,其中不能与氢氧化钠反应的衍生物的结构式有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
下列有关实验装置进行的相应实验,不能达到实验目的是( )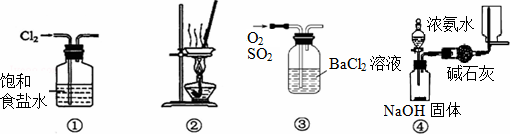

| A、用装置①除去Cl2中含有的少量HCl |
| B、用装置②从KCl溶液中获得KCl晶体 |
| C、用装置③除去O2中混有的一定量SO2 |
| D、用装置④在实验室制取并收集氨气 |
下列事实能说明碳酸的酸性比乙酸弱的是( )
| A、乙酸能发生酯化反应,而碳酸不能 |
| B、碳酸和乙酸都能与碱反应,产物都是弱碱性的盐 |
| C、乙酸易溶于水,在水中的溶解度较大,而碳酸的溶解度较小 |
| D、醋酸可用于清除水垢 |