题目内容
已知:①C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol.
②H2(g)+
O2(g)=H2O(g);△H=-241.8kJ/mol.
现有0.2mol的炭粉和氢气组成的悬浮气在氧气中完全燃烧,共放出55.945kJ热量,则混合物中C(s)与H2的物质的量之比为( )
②H2(g)+
| 1 |
| 2 |
现有0.2mol的炭粉和氢气组成的悬浮气在氧气中完全燃烧,共放出55.945kJ热量,则混合物中C(s)与H2的物质的量之比为( )
| A、1:1 | B、1:2 |
| C、1:3 | D、1:4 |
考点:有关反应热的计算
专题:计算题
分析:物质放出的热量数值与物质的物质的量成正比,依据C、H2燃烧的热化学方程式分别计算出各自反应放出的热量结合0.2mol的炭粉和氢气组成的悬浮气在氧气中完全燃烧,共放出55.945kJ热量,列关系式进行解答.
解答:
解:设0.2mol的炭粉和氢气组成的悬浮气中碳的物质的量为xmol,氢气的物质的量为ymol,
①C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol.
②H2(g)+
O2(g)=H2O(g);△H=-241.8kJ/mol.
xmol碳燃烧放出的热量为393.5xkJ,ymol氢气燃烧放出的热量为241.8ykJ,
由题意得:
解得:
则混合物中C(s)与H2的物质的量之比为0.05mol:0.15mol=1:3,
故选C.
①C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol.
②H2(g)+
| 1 |
| 2 |
xmol碳燃烧放出的热量为393.5xkJ,ymol氢气燃烧放出的热量为241.8ykJ,
由题意得:
|
|
则混合物中C(s)与H2的物质的量之比为0.05mol:0.15mol=1:3,
故选C.
点评:本题考查了热化学方程式的计算,题目较简单,注意热化学反应方程式中物质的量与热量的关系.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
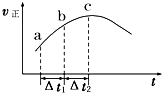 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使可逆反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出正确的结论是( )
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使可逆反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出正确的结论是( )| A、反应在 c 点达到平衡状态 |
| B、反应物浓度:a 点小于 b 点 |
| C、反应物的总能量低于生成物的总能量 |
| D、△t1=△t2 时,SO2 的转化率:a~b 段小于 b~c 段 |
下列图示的操作中,正确的是( )
A、 加热液体 |
B、 熄灭酒精灯 |
C、 读取液体体积 |
D、 过滤 |
下列事实能说明碳酸的酸性比乙酸弱的是( )
| A、乙酸能发生酯化反应,而碳酸不能 |
| B、碳酸和乙酸都能与碱反应,产物都是弱碱性的盐 |
| C、乙酸易溶于水,在水中的溶解度较大,而碳酸的溶解度较小 |
| D、醋酸可用于清除水垢 |

 如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:
如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题: