题目内容
将一定量的铜片加入稀硫酸和硫酸铁混合溶液中若铜完全溶解,测得此时Fe3+,Cu2+,H+的物质的量浓度均为0.1mol.L-1,则c(SO42-)为 .
考点:物质的量浓度的相关计算
专题:
分析:Cu和硫酸不反应,Cu和硫酸铁反应离子方程式为2Fe3++Cu=Cu2++2Fe2+,根据方程式知,溶液中c(Fe2+)=2c(Cu2+)=0.2mol/L,任何电解质溶液都呈电中性,溶液中阴阳离子所带电荷相等,根据电荷相等计算c(SO42-).
解答:
解:Cu和硫酸不反应,Cu和硫酸铁反应离子方程式为2Fe3++Cu=Cu2++2Fe2+,根据方程式知,溶液中c(Fe2+)=2c(Cu2+)=0.2mol/L,任何电解质溶液都呈电中性,溶液中阴阳离子所带电荷相等,根据电荷守恒得2c(Cu2+)+2c(Fe2+)+3c(Fe3+)+c(H+)=2 c(SO42-),则
0.1mol/L×2+0.2mol/L×2+0.1mol/L×3+0.1mol/L=1.0mol/L,
c(SO42-)=
=0.5mol/L,
故答案为:0.5mol/L.
0.1mol/L×2+0.2mol/L×2+0.1mol/L×3+0.1mol/L=1.0mol/L,
c(SO42-)=
| 1.0mol/L |
| 2 |
故答案为:0.5mol/L.
点评:本题以氧化还原反应为载体考查物质的量浓度的计算,侧重考查分析计算能力,注意要计算出亚铁离子浓度再计算硫酸根离子浓度,为易错点.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、核素就是同位素 |
| B、元素的金属性强弱与元素失去电子数的多少成正比 |
| C、含有离子键的化合物一定是离子化合物 |
| D、含有共价键的化合物一定是共价化合物 |
兴奋剂是体育比赛中禁用的药物,有一种兴奋剂的结构如图.关于它的说法中正确的是( )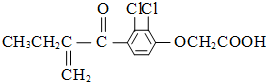

| A、该有机物能发生银镜反应 |
| B、分子中有4个碳碳双键 |
| C、既能发生还原反应,又能发生氧化反应 |
| D、1 mol 该物质最多跟6 mol氢气发生反应 |
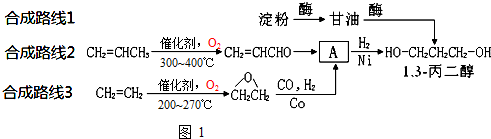
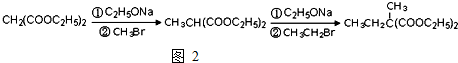
 为原料可以合成聚酯PTT,写出其化学方程式
为原料可以合成聚酯PTT,写出其化学方程式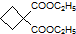 ,再转化为
,再转化为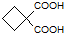 .
.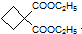 ,必须先合成哪些物质?(用合成该物质的化学方程式回答)
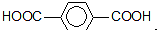
,必须先合成哪些物质?(用合成该物质的化学方程式回答) 已知有机化合物A和B的结构简式分别为
已知有机化合物A和B的结构简式分别为
 ) 的同分异构体有多种,请写出符合以下条件的其中任意一种
) 的同分异构体有多种,请写出符合以下条件的其中任意一种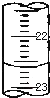 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: