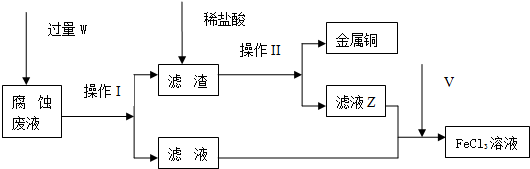
题目内容
16.物质A~K有如下的转化关系,其中D、E为气体单质,试回答(图中有些反应的产物和反应的条件没有全部标出):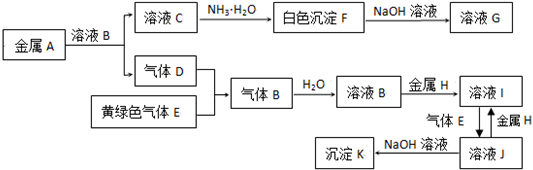
(1)写出下列物质的化学式:D是H2,G是NaAlO2;
(2)写出“C→F”反应的离子方程式Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)写出反应“F→G”的离子方程式Al(OH)3+OH-=AlO2-+2H2O;
(4)写出反应“I→J”的离子方程式2Fe2++Cl2═2Fe3++2Cl-;
(5)在溶液I中滴入NaOH溶液,可观察到的现象是产生白色絮状沉淀,迅速变成灰绿色,最后变成红褐色;写出相关的化学反应方程式4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(6)向200mL 3mol/L溶液J中加入60g铁、铜混合物(铁和铜的物质的量比为1:1),充分反应后过滤,向滤液中通入足量的氨气,充分反应后再过滤、洗涤、干燥、灼烧,灼烧后得到固体的质量为72g.
分析 黄绿色气体电子E为Cl2,金属H与溶液B反应得到I,I能被氯气氧化得到J,而J能与H反应得到I,故金属H为变价金属,可推知H为Fe,B为盐酸,I为FeCl2,J为FeCl3,K为Fe(OH)3,故B为HCl,气体单质D为H2,金属A与盐酸反应得到C为盐,能与氨气反应得到白色沉淀F,且白色沉淀F溶于氢氧化钠溶液得到G,可推知A为Al、C为AlCl3、F为Al(OH)3、G为NaAlO2,据此解答.
解答 解:E为黄绿色气体,则E是Cl2,金属H与溶液B反应得到I,I能和氯气反应得到J,而J能与H反应得到I,可知H为变价金属,则H为Fe,溶液B为盐酸,I为FeCl2,J为FeCl3,K为Fe(OH)3,所以气体B为HCl,则气体D是H2,金属A与盐酸反应得到C为盐,C与氨气反应得到的白色沉淀F能溶于氢氧化钠溶液,所以A是Al、C是AlCl3、F是Al(OH)3、G是NaAlO2;
(1)上述分析可知,D是H2,G是NaAlO2,
故答案为:H2,NaAlO2;
(2)C→F的反应为氯离子在氨水中反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故意答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)F→G的反应为氢氧化铝溶解于氢氧化钠溶液生成偏铝酸钠溶液,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)I→J的反应为氯气氧化亚铁离子诶铁离子,反应的离子方程式:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(5)在FeCl2溶液中滴入NaOH溶液,会生成氢氧化亚铁沉淀,在空气中会被迅速氧化为氢氧化铁,则可观察到的现象是产生白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,化学反应方程式:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(6)200mL 3mol/L FeCl3,n(FeCl3)=0.2×3=0.6mol,60g铁、铜混合物(铁和铜的物质的量比为1:1),则n(Fe)=n(Cu)=60/(56+64)=0.5mol,Fe的还原性强于Cu,则先发生:2Fe3++Fe=3Fe2+,0.6mol Fe3+完全反应需要0.3mol Fe,小于0.5mol,所以溶液中的溶质为氯化亚铁,氯化亚铁的物质的量为0.6mol×3/2=0.9mol,充分反应后过滤,向滤液中通入足量的氨气,充分反应后再过滤、洗涤、干燥、灼烧,灼烧后得到固体为氧化铁,根据Fe元素守恒,氧化铁的物质的量为0.9/2=0.45mol,所以氧化铁的质量为0.45×160=72g,
故答案为:72g.
点评 本题考查无机物推断,“物质的颜色、白色沉淀能与氢氧化钠反应、金属H及生成物转化关系”等是推断突破口,需要学生熟练掌握元素化合物知识,(6)中注意判断最终物质,利用守恒法计算,难度中等.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
| A. | 催化剂可以改变化学反应速率 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 2molSO2与 1molO2一定能生成2molSO3 | |
| D. | 锌与稀硫酸反应时,加入少量铜粉能加快反应 |
| A. | 滴加石蕊显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | [H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | [OH-]/[H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的[H+]=1.0×10-13 mol•L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
| A. | H2C=CH-CN | B. | H2C=CH-CH=CH2 | C. |  | D. |  |
| A. | 该溶液中:c2(H+)≠c(H+)•c(A-)+Kw | |
| B. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)═c(A-)+2c(OH-) |

 或
或 .
.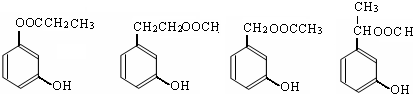 (其中一种).
(其中一种).