题目内容
油脂是高级脂肪酸的甘油酯,在工业上用途广泛.实验一:用地沟油制肥皂(高级脂肪酸钠盐)和甘油(常压下甘油的沸点为290℃).
(1)将约6g地沟油、10mL 40%的烧碱溶液、5mL液体A混合后在烧杯中加热约0.5小时.A可以增大反应物间的接触,则A可以是 (选填编号).
a.四氯化碳 b.汽油 c.乙醇
(2)从皂化反应后的溶液中提取肥皂和甘油的过程如下:
加入食盐颗粒后,液体表面析出白色固体,则食盐的作用是 .操作②必须用到的玻璃仪器是 (选填编号).
a.漏斗 b.分液漏斗 c.蒸馏烧瓶
(3)若甘油的产率明显低于高级脂肪酸钠盐的产率,可能的原因是 (选填编号).
a.油脂水解不充分 b.部分甘油挥发 c.甘油中混有水
实验二:测定油脂的碘值.碘值是指100g油脂中所能吸收 (加成)碘的克数.
称取a g某油脂,加入含bmol I2的溶液(韦氏液),充分振荡;过量的I2用cmol/L Na2S2O3溶液滴定(以淀粉为指示剂)用去vmL.:2Na2S2O3+I2→Na2S4O6+2NaI
(4)配制韦氏液,溶剂选用冰醋酸而不选用水的原因是 .滴定终点时颜色的变化是 .
(5)该油脂的碘值为(用相关字母表示) .
(6)冰醋酸也会消耗Na2S2O3,所以还要做相关实验进行校正,否则会引起测得的碘值偏 (选填“高”或“低”).
(1)将约6g地沟油、10mL 40%的烧碱溶液、5mL液体A混合后在烧杯中加热约0.5小时.A可以增大反应物间的接触,则A可以是
a.四氯化碳 b.汽油 c.乙醇
(2)从皂化反应后的溶液中提取肥皂和甘油的过程如下:

加入食盐颗粒后,液体表面析出白色固体,则食盐的作用是
a.漏斗 b.分液漏斗 c.蒸馏烧瓶
(3)若甘油的产率明显低于高级脂肪酸钠盐的产率,可能的原因是
a.油脂水解不充分 b.部分甘油挥发 c.甘油中混有水
实验二:测定油脂的碘值.碘值是指100g油脂中所能吸收 (加成)碘的克数.
称取a g某油脂,加入含bmol I2的溶液(韦氏液),充分振荡;过量的I2用cmol/L Na2S2O3溶液滴定(以淀粉为指示剂)用去vmL.:2Na2S2O3+I2→Na2S4O6+2NaI
(4)配制韦氏液,溶剂选用冰醋酸而不选用水的原因是
(5)该油脂的碘值为(用相关字母表示)
(6)冰醋酸也会消耗Na2S2O3,所以还要做相关实验进行校正,否则会引起测得的碘值偏
考点:制备实验方案的设计
专题:
分析:(1)乙醇属于有机物,能与水以及油脂混溶;
(2)在皂化反应后的混合物中加食盐可以降低高级脂肪酸钠的溶解度;甘油和水互溶可以用蒸馏的方法分离;
(3)甘油易挥发;
(4)单质碘难溶于水,能溶于乙酸;碘遇到淀粉变蓝色,碘完全反应后,蓝色褪去;
(5)根据Na2S2O3的物质的量求出与其铵盐的碘的物质的量,再求出与油脂反应的碘的量,然后求出碘值;
(6)冰醋酸消耗Na2S2O3,则滴定时消耗的Na2S2O3的物质的量偏大,则与Na2S2O3反应的碘的物质的量偏大,所以与油脂反应的碘偏少.
(2)在皂化反应后的混合物中加食盐可以降低高级脂肪酸钠的溶解度;甘油和水互溶可以用蒸馏的方法分离;
(3)甘油易挥发;
(4)单质碘难溶于水,能溶于乙酸;碘遇到淀粉变蓝色,碘完全反应后,蓝色褪去;
(5)根据Na2S2O3的物质的量求出与其铵盐的碘的物质的量,再求出与油脂反应的碘的量,然后求出碘值;
(6)冰醋酸消耗Na2S2O3,则滴定时消耗的Na2S2O3的物质的量偏大,则与Na2S2O3反应的碘的物质的量偏大,所以与油脂反应的碘偏少.
解答:
解:(1)乙醇属于有机物,能与水以及油脂混溶,而苯、四氯化碳、氯仿不能和氢氧化钠溶液混溶;
故答案为:c;
(2)在皂化反应后的混合物中加食盐可以降低高级脂肪酸钠的溶解度,高级脂肪酸钠以固体的形式析出,所以液体表面析出白色固体;甘油和水互溶可以用蒸馏的方法分离,则操作②分离甘油和水的混合物时必须用到的玻璃仪器是蒸馏烧瓶;
故答案为:降低高级脂肪酸钠盐的溶解度;蒸馏烧瓶;
(3)甘油易挥发,皂化反应反应过程中要进行加热,生成的甘油有部分挥发,所以甘油的产率明显低于高级脂肪酸钠盐的产率;
故答案为:b;
(4)单质碘难溶于水,能溶于乙酸,所以配制韦氏液,溶剂选用冰醋酸;过量的I2用cmol/L Na2S2O3溶液滴定(以淀粉为指示剂),碘与淀粉的混合溶液显蓝色,当碘完全反应后,蓝色褪去,则溶液的蓝色褪去且半分钟不改变即达到滴定终点;
故答案为:I2难溶解于水,溶于乙酸;溶液的蓝色褪去且半分钟不改变;
(5)过量的I2用cmol/L Na2S2O3溶液滴定(以淀粉为指示剂)用去vmL,已知:2Na2S2O3+I2→Na2S4O6+2NaI,则n(I2)=
×cmol/L×V×10-3L=
cV×10-3mol,则与油脂反应的碘的物质的量为(b-
cV×10-3)mol,设碘值为xg,
=
,解得:x=
;
故答案为:
;
(6)冰醋酸消耗Na2S2O3,则滴定时消耗的Na2S2O3的物质的量偏大,则与Na2S2O3反应的碘的物质的量偏大,所以与油脂反应的碘偏少,则测得的碘值偏低;
故答案为:低.
故答案为:c;
(2)在皂化反应后的混合物中加食盐可以降低高级脂肪酸钠的溶解度,高级脂肪酸钠以固体的形式析出,所以液体表面析出白色固体;甘油和水互溶可以用蒸馏的方法分离,则操作②分离甘油和水的混合物时必须用到的玻璃仪器是蒸馏烧瓶;
故答案为:降低高级脂肪酸钠盐的溶解度;蒸馏烧瓶;
(3)甘油易挥发,皂化反应反应过程中要进行加热,生成的甘油有部分挥发,所以甘油的产率明显低于高级脂肪酸钠盐的产率;
故答案为:b;
(4)单质碘难溶于水,能溶于乙酸,所以配制韦氏液,溶剂选用冰醋酸;过量的I2用cmol/L Na2S2O3溶液滴定(以淀粉为指示剂),碘与淀粉的混合溶液显蓝色,当碘完全反应后,蓝色褪去,则溶液的蓝色褪去且半分钟不改变即达到滴定终点;
故答案为:I2难溶解于水,溶于乙酸;溶液的蓝色褪去且半分钟不改变;
(5)过量的I2用cmol/L Na2S2O3溶液滴定(以淀粉为指示剂)用去vmL,已知:2Na2S2O3+I2→Na2S4O6+2NaI,则n(I2)=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| x |
| 100g |
(b-
| ||
| ag |
| 25400b-12.7cv |
| a |
故答案为:
| 25400b-12.7cv |
| a |
(6)冰醋酸消耗Na2S2O3,则滴定时消耗的Na2S2O3的物质的量偏大,则与Na2S2O3反应的碘的物质的量偏大,所以与油脂反应的碘偏少,则测得的碘值偏低;
故答案为:低.
点评:本题考查了物质的制备方案设计,侧重于考查学生的分析能力、实验探究能力和数据处理能力,题目难度中等,注意把握油脂的性质以及皂化反应的反应条件.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某种由Na2S、Na2SO3、Na2SO4组成的固体混合物中,已知S的质量分数为25.6%,则氧的质量分数为( )
| A、51.2% | B、36.8% |
| C、37.6% | D、无法计算 |
下列各项操作中不发生先沉淀后溶解现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴加入过量H2SO4
③向Ba(NO3)2溶液中通入过量SO3
④向石灰水中通入过量CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸.
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴加入过量H2SO4
③向Ba(NO3)2溶液中通入过量SO3
④向石灰水中通入过量CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸.
| A、①②③ | B、①②⑤ |
| C、①②③⑤ | D、①③⑤ |
铝能用于冶炼金属铁、钒、铬、锰等,其原因是铝具有( )
| A、两性 |
| B、导电性好 |
| C、熔点低 |
| D、还原性强,且反应放出大量热 |
 如图是实验室制取的气体发生装置,请结合所学知识,回答下列问题:
如图是实验室制取的气体发生装置,请结合所学知识,回答下列问题: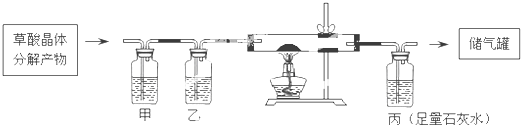

 .
. )的合成路线流程图(必要条件需注明,无机试剂任选).合成路线流程图示例如下:
)的合成路线流程图(必要条件需注明,无机试剂任选).合成路线流程图示例如下: