题目内容
1.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(Lmin).求:(1)平衡时D的浓度=1.2mol/L,
(2)B的平均反应速率υ(B)=0.12mol/( L.min)
(3)x=3.
(4)开始时容器中的压强与平衡时的压强之比为10:11,(化为最简整数比)
分析 3A(g)+B(g)?xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,则
3A(g)+B(g)?xC(g)+2D(g),
开始(mol/L) 3 3 0 0
转化 3×60% 0.6 1.2
平衡 1.2 2.4 0.6x 1.2
(1)由上述分析可知平衡状态D的浓度;
(2)结合v=$\frac{△c}{△t}$计算;
(3)结合速率之比等于化学计量数之比计算;
(4)开始时容器中的压强与平衡时的压强之比等于反应前后的物质的量之和的比.
解答 解:3A(g)+B(g)?xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,则
3A(g)+B(g)?xC(g)+2D(g),
开始(mol/L) 3 3 0 0
转化 3×60% 0.6 1.2
平衡 1.2 2.4 0.6x 1.2
(1)由上述分析可知平衡状态D的浓度为1.2mol/L,故答案为:1.2;
(2)B的平均反应速率υ(B)=$\frac{0.6mol/L}{5min}$=0.12mol/( L.min),故答案为:0.12;
(3)由速率之比等于化学计量数之比可知,$\frac{1}{x}=\frac{0.12}{0.36}$,解得x=3,故答案为:3;
(4)开始时容器中的压强与平衡时的压强之比等于反应前后的物质的量之和的比,为(6+6)mol:(1.2+2.4+0.6×3+1.2)mol/L×2L=10:11,故答案为:10:11.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法计算、速率及压强比的计算方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.

| A. | 电子云伸展方向与电子的能量大小是无关的 | |
| B. | 只含极性键的分子一定是极性分子 | |
| C. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| D. | H-O键键能为462.8 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×462.8 kJ |
| A. | ①③④ | B. | ②③⑥ | C. | ①②④ | D. | ③④⑤ |
| A. | 熔点由高到低:NaCl>Na-K合金>Na | |
| B. | 晶体的熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| C. | 晶体的硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 晶体的晶格能由大到小:NaF>NaCl>NaBr>NaI |
| A. | 电子离核越近,能量越高 | |
| B. | 原子核外电子的运动没有规律 | |
| C. | 在多电子原子中,核外电子分层排布 | |
| D. | 电子一般尽可能排布在能量高的电子层中 |
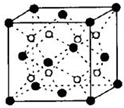 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:
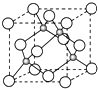 A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空: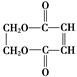 )可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图:
)可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图: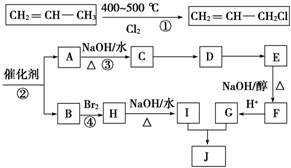
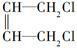 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$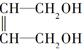 +2NaCl.
+2NaCl. ,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).
,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).