题目内容
11. 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:(1)写出基态E原子的电子排布式[Ar]3d104s1.
(2)1mol A的单质分子中π键的个数为2NA.
(3)A、B、C 三种元素的氢化物稳定性由强到弱的顺序为HF>H2O>NH3 (用化学式表示).
(4)A的简单氢化物分子的空间构型为三角锥形,其中A原子的杂化类型是sp3.
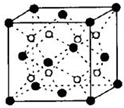
(5)C和D形成的化合物的晶胞结构如图,已知晶胞边长a cm,阿伏加德罗常数为NA,求晶体的密度为ρ=$\frac{312}{{a}^{3}{N}_{A}}$g/cm3.(用含a、NA的计算式表示)
分析 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5,所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式[Ar]3d104s1,则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素,据此解答.
解答 解:有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5,所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式[Ar]3d104s1,则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素,
(1)E是铜元素,根据构造原理知,其基态原子的价电子排布式[Ar]3d104s1,
故答案为:[Ar]3d104s1;
(2)氮气的结构式为:N≡N,所以氮气分子中含有一个σ键两个π键,因此1mol氮气中含有2molπ键,即为2NA个π键,
故答案为:2NA;
(3)非金属性F>O>N,非金属性越强,其气态氢化物越稳定,因此气态氢化物的稳定性HF>H2O>NH3,
故答案为:HF>H2O>NH3;
(4)N元素的简单氢化物是氨气,NH3分子中氮原子价层电子对=3+$\frac{5-1×3}{2}$=4,且含有一个孤电子对,所以分子空间构型是三角锥形,N原子采取sp3杂化,
故答案为:三角锥形;sp3;
(5)F和Ca形成的化合物为CaF2,由晶胞结构可知,晶胞中白色球数目=8、黑色球数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,白色球为F、黑色球为Ca,则晶胞质量=4×$\frac{78g}{{N}_{A}}$=$\frac{312}{{N}_{A}}$g,晶胞的体积为a3cm3,晶体的密度为ρ=$\frac{\frac{312}{{N}_{A}}g}{{a}^{3}c{m}^{3}}$=$\frac{312}{{a}^{3}{N}_{A}}$g/cm3,
故答案为:$\frac{312}{{a}^{3}{N}_{A}}$.
点评 本题考查位置结构与性质的应用,题目难度中等,涉及核外电子排布、分子空间构型、化学键、杂化方式、电离能、晶胞计算等,都是考试热点.

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案| A. | 分子中四个原子共直线,且C为SP杂化 | |
| B. | 分子中N≡C键的键长大于C-C键的键长 | |
| C. | 分子中含有2个σ键和4个π键 | |
| D. | 不和氢氧化钠溶液发生反应 |

| A. | 分子式为C16H16O9 | |
| B. | 能与碳酸钠溶液反应,但不产生二氧化碳 | |
| C. | 能发生催化氧化反应并生成能发生银镜反应的产物 | |
| D. | NaOH、H2、溴水分别与1mol绿原酸反应时,消耗反应物的最大物质的量都为4mol |
 ①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,则该烷烃的结构简式为(CH3)2CHCH2CH2CH3.
①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,则该烷烃的结构简式为(CH3)2CHCH2CH2CH3.