题目内容
12.常温下、某无色溶液大量存在下列H+、Na+、Fe3+、Ba2+、OH-、NO3-、SO42-、CO32-离子中的三种,且离子的物质的量相等.向其中滴加酚酞试液不变红色,该溶液中一定不含( )| A. | NO3- | B. | SO42- | C. | Na+ | D. | H+ |
分析 无色溶液,一定不含Fe3+,向其中滴加酚酞试液不变红色,则溶液显酸性,一定含H+,不能存在OH-、CO32-,结合三种离子的物质的量相等及溶液为电中性来解答.
解答 解:无色溶液,一定不含Fe3+,向其中滴加酚酞试液不变红色,则溶液显酸性,一定含H+,不能存在OH-、CO32-,
由三种离子的物质的量相等及溶液为电中性可知,
溶液中存在H+、Na+、SO42-,1×1+1×1=1×2遵循电荷守恒,存在SO42-时,溶液中不能存在Ba2+,而存在NO3-不满足题意,则不含NO3-,
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,注意溶液电中性为解答的易错点,题目难度中等.

练习册系列答案
相关题目
2.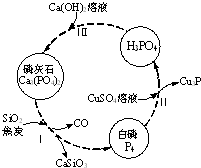 磷及部分重要化合物的相互转化如图所示.
磷及部分重要化合物的相互转化如图所示.
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为0.05mol.
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有Ca (H2PO4)2、CaHPO4.
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
(3)磷灰石中,碳元素的质量分数为1.66%%(保留两位小数).
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4114.87g(保留两位小数).
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值.
 磷及部分重要化合物的相互转化如图所示.
磷及部分重要化合物的相互转化如图所示.(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为0.05mol.
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有Ca (H2PO4)2、CaHPO4.
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
| 成分 | CaO | P2O5 | SO3 | CO2 |
| 质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4114.87g(保留两位小数).
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值.
3.已知N2(g)+3H2(g)?2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是( )
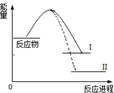

| A. | 1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热 | |
| B. | N2(g)+3H2(g)?2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1 | |
| C. | 选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少 | |
| D. | 2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温 |
20.有关共价分子的说法正确的是( )
| A. | 都是极性分子 | |
| B. | 都是共价化合物 | |
| C. | 共价分子间的作用力都比化学键弱 | |
| D. | 溶于水的共价分子都能产生自由移动的离子 |
7.把少量过氧化钠投入下列溶液中,有白色沉淀生成的是( )
| A. | 1mol/L氢氧化钠 | B. | 饱和碳酸氢钠 | C. | 1mol/L硫酸亚铁 | D. | 饱和碳酸钠 |
2.用氯气和绿矾处理水,下列说法错误的是( )
| A. | 氯气起杀菌消毒作用 | B. | 氯气氧化绿矾 | ||
| C. | 绿矾具有净水作用 | D. | 绿矾的氧化产物具有净水作用 |
