题目内容
1.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是I(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |

请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)已知${{ClO}_{2}}^{-}$为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O或OF2.
(6)如图1为碘晶体晶胞结构.有关说法中正确的是C.
A.用均摊法可知平均每个晶胞中有4个碘原子
B.碘晶体为无限延伸的空间结构,是原子晶体
C.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见如图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρN{\;}_{A}}{4}$.

分析 (1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子;
(2)根据氢键分析解答;
(3)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;
(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(5)根据价层电子对互斥理论来确定其杂化方式,价层电子对个数=σ键个数+孤电子对个数;等电子体是具有相同的价电子数和相同原子数的微粒;
(6)碘为分子晶体,晶胞中占据顶点和面心,以此分析;
(7)利用均摊法确定该立方体中含有的离子,根据ρV=nM计算相对分子质量.
解答 解:(1)解:根据构造原理知,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的p区;溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为4s24p5,
故答案为:p;4s24p5;
(2)HF分子之间存在氢键,使氢氟酸分子缔合,
故答案为:氢键;
(3)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,
故答案为:I;
(4)H5IO6(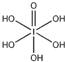 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO3,故答案为:>;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO3,故答案为:>;
(5)ClO2-中心氯原子的价层电子对数n=2+$\frac{7+1-2×2}{2}$=4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2-互为等电子体的分子为Cl2O、OF2等,
故答案为:sp3;Cl2O或OF2;
(6)A.用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子,故A错误;
B.碘晶体为无限延伸的空间结构,构成微粒为分子,是分子晶体,故B错误;
C.碘晶体中的碘原子间存在I-I非极性键,且晶体中分子之间存在范德华力,故C正确;
故答案为:C;
(7)该晶胞中含有钙离子个数=$8×\frac{1}{8}+6×\frac{1}{2}$=4,氟离子个数为8,则晶胞体积V=a3,CaF2密度为=$\frac{m}{V}$=$\frac{M×4}{VN{\;}_{A}}$=ρ,则CaF2的相对分子质量M=$\frac{{a}^{3}ρN{\;}_{A}}{4}$,
故答案为:$\frac{{a}^{3}ρN{\;}_{A}}{4}$.
点评 本题考查物质结构与性质,题量较大,比较综合,涉及元素周期表、核外电子排布、分子结构与性质、电离能、杂化轨道、等电子体等,侧重对主干知识的考查,需要学生熟练掌握基础知识,难度中等.

| A. | 制备Fe(OH)3胶体:Fe3++3OH-=Fe(OH)3↓ | |
| B. | 稀硝酸中加入过量的铁粉:3Fe+2NO${\;}_{3}^{-}$+8H+=3Fe2++2NO↑+4H2O | |
| C. | 向Na2SiO3溶液中加入通入过量的H2S:SiO32-+H2SiO3↓+S2- | |
| D. | 向含amolFel2的水溶液中通入amol的Cl2反应为:2Fe2-+2l-+2Cl2=2Fe2++4Cl-+l2 |
| A. | 2,3-二乙基戊烷 | B. | 5-甲基-3-乙基已烷 | ||
| C. | 2-甲基-4-乙基戊烷 | D. | 2,3,3-三甲基戊烷 |

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)用氧化物形式表示LiAlSi2O6的组成:Li2O•Al2O3•4SiO2.
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4,控制pH,使Fe3+、Al3+完全沉淀.
(3)写出沉淀A的成分Mg(OH)2、CaCO3.
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称过滤,洗涤所得Li2CO3沉淀要使用热水 (选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
| A. | 在28 g聚乙烯树脂中,含有的碳原子数目为2NA | |
| B. | 在合成28 g聚乙烯树脂的单体中,含有的双键数目为NA | |
| C. | 28 g聚乙烯树脂完全燃烧时,转移的电子数目为3NA | |
| D. | 28 g聚乙烯树脂中,含有的C-H键的数目为4NA |
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | Mg条插入NaOH溶液中 | 有气泡产生 | Mg可以和NaOH溶液反应 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰无紫色 | 原溶液中无K+ |
| C | 用玻璃棒蘸取氨水点到红色石蕊试纸上 | 试纸变蓝色 | 氨水呈碱性 |
| D | CO2通入CaCl2水溶液中 | 溶液变浑浊 | 生成CaCO3沉淀 |
| A. | A | B. | B | C. | C | D. | D |
 按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)
按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)