题目内容
9. 他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.甲同学研究的实验报告如表:
他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.甲同学研究的实验报告如表:| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快. |
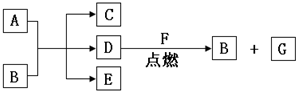
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验.完成该实验应选用的实验药品是Mg(或Fe)和0.5mol/L硫酸和2mol/L硫酸;应该测定的实验数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间.
分析 (1)根据表中数据可知,硫酸的浓度相同,不同金属的规格相同,说明实验目的是探究反应物本身对反应速率的影响;影响反应速率的还有温度,所以应该使反应温度相同;
(2)根据图示装置及选取的试剂可知,实验目的是通过测定反应生成氢气快慢进行判断浓度对反应速率的影响.
解答 解:(1)根据表中的信息得出该同学的实验目的是研究反应物本身的性质对反应速率的关系对反应速率的影响;温度对化学反应速率的影响较大,故根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持温度相同,
故答案为:探究反应物本身的性质对反应速率的影响;温度相同;
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置进行定量实验,图1中药品是金属和酸,浓硫酸和铁发生钝化现象而影响判断,所以完成该实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L稀硫酸,根据v=$\frac{△V}{△t}$知应该测定的实验数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间,
故答案为:Mg(或Fe)和0.5 mol/L硫酸和2 mol/L硫酸;测定一定时间产生气体的体积或测定产生一定体积的气体所需时间.
点评 本题以化学反应速率的影响因素为载体,侧重考查学生猜想、比较、分析、创新、发散思维的能力,难度较大,需认真、细心分析才能正确解答.

练习册系列答案
相关题目
19.NA为阿伏加德罗常数,下述正确的是( )
| A. | 64gSO2含有硫原子数为2NA | |
| B. | NA个氧分子和NA个氢分子的质量比等于16:1 | |
| C. | 常温常压下,11.2L氧气所含的原子数为NA | |
| D. | 标准状况下,22.4L的水含有NA个水分子 |
20.工业上通过2Al2O3+3C+6Cl2$\frac{\underline{\;高温\;}}{\;}$4AlCl3+3CO2制取无水氯化铝,下列说法正确的是( )
| A. | Cl2发生氧化反应 | B. | Cl2是还原剂 | ||
| C. | 若生成11gCO2,则转移3mol电子 | D. | C失去电子 |
14.从物质的量浓度为0.075mol•L-1的CaCl2溶液中取出2L溶液,则Cl-为( )
| A. | 9.03×1022 | B. | 0.15mol | C. | 10.65g | D. | 0.075mol•L-1 |
6.下列关于铜-锌-稀硫酸构成的原电池的有关叙述,错误的是( )
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极,电极反应式:2H++2e-═H2↑ | |
| C. | 电解质溶液中,SO42-向正极方向移动 | |
| D. | 外电路电子流入的一极为正极,电子流出的一极为负极 |
3.下列指定反应的离子方程式正确的是( )
| A. | NO2溶于水:3NO2+H2O=2H++2NO3-+NO↑ | |
| B. | 用氨水吸收过量的SO2气体:2OH-+SO2=SO32-+H2O | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
 .
.