题目内容
(8分)短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
(1)C的最高价氧化物对应水化物中含有的化学键类型为 。
(2)写出由AB两种元素组成1:1化合物的电子式
(3)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 ________________________________ 。
(4)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是 (填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质和AD溶液
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(8分)(1)离子键和共价键;(2)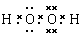 ;(3)2I-+ClO-+H2O=I2+Cl-+2OH-;(4)①③④。
;(3)2I-+ClO-+H2O=I2+Cl-+2OH-;(4)①③④。
【解析】
试题分析:根据题意可推知:A是H;B是O;C是Na;D是Cl;E是Fe。(1)C的最高价氧化物对应水化物NaOH中含有的化学键类型为离子键、共价键;(2)由AB两种元素组成1:1化合物H2O2的电子式是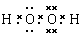 ;(3)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,说明该盐有强的氧化性,则该盐是NaClO,则反应的离子方程式为2I-+ClO-+H2O=I2+Cl-+2OH-;(4)E元素与D元素可形成FeCl2和FeCl3两种化合物,①FeCl2是强酸弱碱盐,Fe2+发生水解反应使溶液变浑浊,而且Fe2+有还原性,容易被空气中的氧气氧化为Fe3+.所以保存FeCl2溶液时,需向溶液中加入少量Fe单质防止其氧化,加入HCl溶液防止其水解,正确;②2FeCl3+Fe= 3FeCl2;所以FeCl2也可以通过化合反应生成,FeCl3只能通过化合反应生成,错误;③铜片、碳棒和FeCl3溶液组成原电池,由于Cu的活动性大于C,所以Cu最负极,C作正极,电子由负极铜片沿导线流向碳棒,正确;④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴FeCl3的浓溶液,苯酚与FeCl3发生显色反应,溶液变为紫色;FeCl3有强氧化性,与碘化钾溶液发生氧化还原反应产生I2,I2遇淀粉溶液变为紫色,因此原无色溶液都变成紫色,正确;
;(3)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,说明该盐有强的氧化性,则该盐是NaClO,则反应的离子方程式为2I-+ClO-+H2O=I2+Cl-+2OH-;(4)E元素与D元素可形成FeCl2和FeCl3两种化合物,①FeCl2是强酸弱碱盐,Fe2+发生水解反应使溶液变浑浊,而且Fe2+有还原性,容易被空气中的氧气氧化为Fe3+.所以保存FeCl2溶液时,需向溶液中加入少量Fe单质防止其氧化,加入HCl溶液防止其水解,正确;②2FeCl3+Fe= 3FeCl2;所以FeCl2也可以通过化合反应生成,FeCl3只能通过化合反应生成,错误;③铜片、碳棒和FeCl3溶液组成原电池,由于Cu的活动性大于C,所以Cu最负极,C作正极,电子由负极铜片沿导线流向碳棒,正确;④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴FeCl3的浓溶液,苯酚与FeCl3发生显色反应,溶液变为紫色;FeCl3有强氧化性,与碘化钾溶液发生氧化还原反应产生I2,I2遇淀粉溶液变为紫色,因此原无色溶液都变成紫色,正确;
考点:考查元素及化合物的推断、物质内的化学键的类型、电子式是书写、离子方程式的书写、物质的保存、制取、原电池反应原理及物质的性质的应用的知识。

利用如图所示装置进行下列实验,能得出相应实验结论的是

选项 | ① | ② | ③ | 实验结论 |
A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 |
B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 |
C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性Cl>C>Si |
(22分)现有下列九种物质:
①H2 ②铝 ③CuO ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
分类标准 | 能导电 | 非电解质 | 电解质 |
属于该类的物质 |
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH-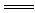 H2O,该离子反应对应的化学方程式为 。
H2O,该离子反应对应的化学方程式为 。
(3)⑨在水中的电离方程式为 ,
34.2g⑨溶于水配成250mL溶液, SO42-的物质的量浓度为 。
(4)少量的④通入⑥的溶液中反应的离子方程式为: 。
(5)将②加入NaOH的溶液中反应的离子方程式
(6)②与⑧发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是
(填化学式),还原剂与氧化剂的物质的量之比是 ,当有5.4g Al发生反应时,转移电子的物质的量为 。
 As、
As、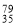 Br位于同一周期。下列关系正确的是
Br位于同一周期。下列关系正确的是