题目内容
1.某化学小组进行了硫代硫酸钠(Na2S2O3)的探究,首先通过查阅资料得到如下信息:a.Na2S2O3、BaS2O3均易溶于水;b.Na2S2O3晶体在空气中易被氧化.然后进行如下实验:
【实验一】硫代硫酸钠(Na2S2O3)的制取实验室制备装置如图所示(夹持装置已省略):
回答问题:
(1)①装置B中的长颈漏斗的作用是平衡压强.
②B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(2)在装置C中有Na2S2O3生成.
①写出装置C中反应的化学方程式:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
②结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到Na2S2O3•5H2O.
(3)装置E中为NaOH溶液.
【实验二】硫代硫酸钠(Na2S2O3)的性质
(4)Na2S2O3在酸性溶液中不能稳定存在.请用离子方程式表示该过程:2H++S2O32-=SO2↑+S↓+H2O
(5)如何检验Na2S2O3晶体在空气中已被氧化?少量Na2S2O3晶体于试管中,加适量水溶解,滴加少量的氯化钡溶液,如有白色沉淀生成,说明已被氧化.
【实验三】用Na2S2O3测定废水中的Ba2+
(6)工业上常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 00mol•L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
| 实验编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准 溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
I2+2S2O32-═2I-+S4O64-.
①判断达到滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,
②计算废水中Ba2+的物质的量浓度9.6×10-4mol•L-1.
分析 (1)①B是安全瓶,用来平衡压强;
②根据该液体不能与二氧化硫反应来解答;
(2)①A装置产生的二氧化硫,进入C中,与Na2S和Na2CO3反应得到Na2S2O3;
②从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法;
(3)尾气二氧化硫有毒,污染环境,通过碱性溶液吸收;
(4)硫代硫酸根离子在酸性条件下发生氧化还原反应生成二氧化硫、单质硫和水;
(5)Na2S2O3晶体在空气中被氧化生成Na2SO4,即检验硫酸根离子;
(6)①根据滴定过程中有碘单质参与,可以选用淀粉作为指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
②先根据数据的有效性确定消耗Na2S2O3标准溶液的体积,BaCrO4用盐酸溶解转化为Cr2O72-,由元素守恒及已知方程式可得关系式:2Ba2+~2BaCrO4~Cr2O72-~3I2~6Na2S2O3,结合消耗的Na2S2O3利用关系式计算溶液中n(Ba2+),进而计算c(Ba2+);
解答 解:(1)①B是安全瓶,装置B中的长颈漏斗用来平衡压强;
故答案为:平衡压强;
②a.蒸馏水能与二氧化硫反应生成亚硫酸,故a错误,
b.饱和Na2SO3溶液与二氧化硫反应生成亚硫酸氢钠,故b错误;
c.饱和NaHSO3溶液与二氧化硫不反应,符合题意,故c正确;
d.饱和NaHCO3溶液能与二氧化硫反应生成亚硫酸钠和二氧化碳,故d错误;
故选:c;
(2)①A装置产生的二氧化硫,进入C中,与Na2S和Na2CO3反应得到Na2S2O3,方程式为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;
故答案为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2;
②从C中溶液得到Na2S2O3•5H2O,需要经蒸发浓缩、冷却结晶、过滤洗涤、干燥,
故答案为:蒸发浓缩、冷却结晶、过滤洗涤;
(3)尾气二氧化硫有毒,污染环境,通过NaOH溶液吸收;
故答案为:NaOH;
(4)硫代硫酸根离子在酸性条件下发生氧化还原反应生成二氧化硫、单质硫和水,离子方程式为:2H++S2O32-=SO2↑+S↓+H2O;
故答案为:2H++S2O32-=SO2↑+S↓+H2O;
(5)Na2S2O3晶体在空气中被氧化生成Na2SO4,则取少量Na2S2O3晶体于试管中,加适量水溶解,滴加少量的氯化钡溶液,如有白色沉淀生成,说明已被氧化;
故答案为:取少量Na2S2O3晶体于试管中,加适量水溶解,滴加少量的氯化钡溶液,如有白色沉淀生成,说明已被氧化;
(6)①碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点,
故答案为:滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色;
②根据表中数据可知,第4次实验中消耗I2标准溶液的体积偏大,舍去,则实际消耗I2标准溶液的体积的平均值是$\frac{18.02+17.98+18.00}{3}$ml=18.00ml,BaCrO4用盐酸溶解转化为Cr2O72-,由元素守恒及已知方程式可得关系式:2Ba2+~2BaCrO4~Cr2O72-~3I2~6Na2S2O3,消耗的Na2S2O3为0.018L×0.00100mol•L-1,则$\frac{Vml}{4}$溶液中n(Ba2+)=0.018L×0.00100mol•L-1×$\frac{1}{3}$=6×10-6mol,Vml溶液中n(Ba2+)=6×10-6mol×4=2.4×10-5mol,故溶液中c(Ba2+)=$\frac{2.4×1{0}^{-5}mol}{0.025L}$=9.6×10-4mol•L-1;
故答案为:9.6×10-4mol•L-1.
点评 本题主要考查物质的制备、性质以及含量的测定,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养,难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 加入甲醇的电极是电池的正极 | |
| B. | 电池工作时氧气发生氧化反应 | |
| C. | 电池负极反应式为O2+4H++4e-═2H2O | |
| D. | 电池工作后电解质溶液碱性减弱 |
 2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,该反应过程能量变化如图所示,下列叙述中正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,该反应过程能量变化如图所示,下列叙述中正确的是( )| A. | 该反应的反应物总能量小于生成物总能量 | |
| B. | 该反应的逆反应为吸热反应 | |
| C. | 图中△H=-99kJ•mol-1, | |
| D. | 图中字母E所示能量值表示该反应的活化能 |
 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.(1)将反应速率的影响条件填在空格处.
| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | |
| ②工业炼铁时,把铁矿石预先粉碎后,再进行炼制 | |
| ③用H2O2分解制O2,加入MnO2 |
①该反应的化学方程式为2A?2B+C;
(2)2min内,用C表示的反应速率为0.05mol/(L•min).
③在其他条件下,测得A的反应速率为0.05mol•L-1•min-1,此时的反应与800b℃时相比.
a.比800℃时快 b.比800℃时慢 c.与800℃时速率相等 d.无法确定
(3)判断该反应达到平衡状态的标志是ce
a.A和B的浓度相等
b.v(B)=2v(C)
c.容器内气体压强不再改变
d.密闭容器中混合气体的密度不变
e.容器内A的体积分数不再改变.
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.用铁触媒加快化学反应速率 B.采用较高压强(20MPa~50MPa)
C.采用较高温度(400℃~500℃) D.将生成的氨液化并及时从体系中分离出来.
| A. | 加金属钠 | B. | 加入无水硫酸铜 | C. | 加热蒸馏 | D. | 加无水氯化钙 |
| A. | 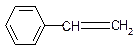 | B. | 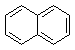 | C. | 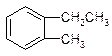 | D. | 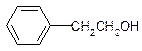 |
