题目内容
2.下列各组化合物中,化学键类型完全相同的是( )| A. | CaH2和Na2S | B. | Na2O和Na2O2 | C. | NaOH和CaO | D. | H2O2和CO2 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
解答 解:A.均只含离子键,故A选;
B.Na2O只含离子键,Na2O2含离子键和共价键,故B不选;
C.CaO只含离子键,NaOH中含离子键和共价键,故C不选;
D.CO2含极性共价键,过氧化氢中含极性键和非极性键,故D不选;
故选A.
点评 本题考查化学键,为高频考点,把握官化学键的形成及判断的一般规律等为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
12.反应类型相同的一组是( )
| A. | 实验室制乙烯和实验室制乙炔 | |
| B. | 苯酚制三溴苯酚和乙醛制乙醇 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色和乙醛使溴水褪色 | |
| D. | 乙酸乙酯的水解和乙烯制聚乙烯 |
10.下列离子与氖原子具有相同核外电子数的有( )
| A. | Mg2+ | B. | O2- | C. | Al3+ | D. | S2- |
17.下面表格中的实验操作、实验现象和结论均正确且相符的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸只表现脱水性 |
| B | 将盐酸滴入Na2CO3溶液中 | 有气泡产生 | 氯的非金属性比碳强 |
| C | 向某溶液中加入浓NaOH溶液并加热, 在试管口用湿润的红色石蕊试纸检验 | 试纸变蓝 | 原溶液中含有NH4+ |
| D | SO2通入品红溶液中 | 溶液褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
11.1mol丙醇与3mol乙酸在一定条件下反应生成乙酸乙酯和水,下列关于该反应的说法正确的是( )
| A. | 丙醇与乙酸的反应条件通常是浓硫酸、加热 | |
| B. | 充分反应可以生成1mol乙酸乙酯 | |
| C. | 生成的乙酸丙酯和水的物质的量之比是1:2 | |
| D. | 反应结束时,剩余2mol乙酸 |
1.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分,也可用来制备多种铁的化合物.回答下列问题:
(1)实验室以绿矾为原料,通过以下过程制备磁性Fe3O4胶体粒子:
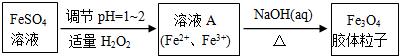
①写出FeSO4溶液转化为溶液A发生反应的离子方程式:2Fe2++H2O2+2H+═2Fe3++2H2O.
②Fe3O4胶体粒子不能用过滤法实现分离,理由是胶体粒子的直径较小(在10-7~10-9m),过滤时可透过滤纸.
③一定条件下,Fe3+水解生成聚合物的离子方程式为:xFe3++yH2O?Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法有abd(填字母).
a.加水稀释 b.加入少量NaCl溶液
c.降温 d.加入少量Na2CO3固体
④设计一个实验,证明溶液A中既含有Fe3+又含有Fe2+:取少量溶液A于洁净的试管中,加入硫氰化钾溶液,溶液显红色,说明溶液中含有Fe3+;另取少量溶液A于另一洁净的试管中,滴入酸性高锰酸钾溶液,振荡后溶液颜色从紫红色变成黄色说明溶液含有Fe2+.
(2)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾通过下列反应制备:
FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O
下表列出了Fe2+生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
①制备FeCO3时,将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中,目的是避免生成Fe(OH)2沉淀.
②将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌充分反应.反应结束后,无需过滤,再加入适量的柠檬酸溶液即可除去过量铁粉.该反应的化学方程式为Fe+C6H8O7=FeC6H6O7+H2↑.
③上述溶液经浓缩后,加入适量无水乙醇,静置、过滤、洗涤、干燥,得到柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
(3)正常人每天应补充13.0mg左右的铁,如果全部通过服用含FeSO4•7H2O的片剂来补充铁,则正常人每天需服用含64.5mg FeSO4•7H2O的片剂(保留一位小数).
(1)实验室以绿矾为原料,通过以下过程制备磁性Fe3O4胶体粒子:
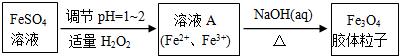
①写出FeSO4溶液转化为溶液A发生反应的离子方程式:2Fe2++H2O2+2H+═2Fe3++2H2O.
②Fe3O4胶体粒子不能用过滤法实现分离,理由是胶体粒子的直径较小(在10-7~10-9m),过滤时可透过滤纸.
③一定条件下,Fe3+水解生成聚合物的离子方程式为:xFe3++yH2O?Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法有abd(填字母).
a.加水稀释 b.加入少量NaCl溶液
c.降温 d.加入少量Na2CO3固体
④设计一个实验,证明溶液A中既含有Fe3+又含有Fe2+:取少量溶液A于洁净的试管中,加入硫氰化钾溶液,溶液显红色,说明溶液中含有Fe3+;另取少量溶液A于另一洁净的试管中,滴入酸性高锰酸钾溶液,振荡后溶液颜色从紫红色变成黄色说明溶液含有Fe2+.
(2)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾通过下列反应制备:
FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O
下表列出了Fe2+生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 5.8 | 8.8 |
②将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌充分反应.反应结束后,无需过滤,再加入适量的柠檬酸溶液即可除去过量铁粉.该反应的化学方程式为Fe+C6H8O7=FeC6H6O7+H2↑.
③上述溶液经浓缩后,加入适量无水乙醇,静置、过滤、洗涤、干燥,得到柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
(3)正常人每天应补充13.0mg左右的铁,如果全部通过服用含FeSO4•7H2O的片剂来补充铁,则正常人每天需服用含64.5mg FeSO4•7H2O的片剂(保留一位小数).
