题目内容
11.下表给出了六种元素的相关信息,其中A、B、C、D、E为都周期元素.| 元素 | 相 关 信 息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝. |
| D | 室温下其单质呈淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂. |
| F | 它是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等. |
(1)A元素符号H F元素的名称铁.
(2)C元素在周期表中的位置第二周期VA族.
(3)D元素原子结构示意图
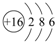 .
.(4)E元素最高价氧化物对应水化物化学式为NaOH,其含有的化学键类型为离子键、共价键.
(5)B和D对应的气态氢化物中,热稳定性较强的是H2O,熔沸点较高的是H2O.(用具体的化学式表示)
(6)D的最高价含氧酸稀溶液与F单质反应的离子方程式Fe+2H+=Fe2++H2↑.
分析 在常温、常压下,A的单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料,可知A为H元素;工业上通过分离液态空气获得B的单质,其某种同素异形体是保护地球地表环境的重要屏障,则B为O元素;C元素是植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,则C为N元素;室温下D单质呈淡黄色粉末状固体,加热易熔化,该单质在氧气中燃烧,发出明亮的蓝紫色火焰,则D为S元素;E在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂,则E为Na;F是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等,则F为Fe,据此解答.
解答 解:在常温、常压下,A的单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料,可知A为H元素;工业上通过分离液态空气获得B的单质,其某种同素异形体是保护地球地表环境的重要屏障,则B为O元素;C元素是植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,则C为N元素;室温下D单质呈淡黄色粉末状固体,加热易熔化,该单质在氧气中燃烧,发出明亮的蓝紫色火焰,则D为S元素;E在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂,则E为Na;F是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等,则F为Fe.
(1)A元素符号为H F元素的名称为铁,故答案为:H;铁;
(2)C为N元素,在周期表中的位置:第二周期VA族,故答案为:第二周期VA族;
(3)D为S元素,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)E元素最高价氧化物对应水化物化学式为NaOH,其含有的化学键类型为:离子键、共价键,故答案为:NaOH;离子键、共价键;
(5)非金属性O>S,故氢化物热稳定性:H2O>H2S,水分子之间存在氢键,故H2O的熔沸点较高,故答案为:H2O;H2O;
(6)D的最高价含氧酸为硫酸,稀硫酸溶液与Fe单质反应的离子方程式:Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑.
点评 本题考查结构性质位置关系应用,需要学生熟练掌握元素化合物性质,比较基础.

 (2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:
(2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:已知:
| 乙醇 | 2-羟基-4-苯基丁酸 | 2-羟基-4-苯基丁酸乙酯 | |
| 相对分子质量 | 46 | 180 | 208 |
| 状态 | 无色液体 | 白色固体 | 无色液体 |
| 沸点/℃ | 78.4 | 356.9 | 212 |
| 密度/g/cm3 | 0.789 | 1.219 | 1.075 |
| 溶解性 | 易溶于水、有机溶剂 | 能溶于水,易溶于有机溶剂 | 难溶于水,易溶于有机溶剂 |

实验步骤:
①按如图1装置连接仪器
②将18.00g 2-羟基-4-苯基丁酸加入三颈瓶中,加入20mL无水乙醇和适量浓硫酸,再加入几块沸石.
③加热至70℃左右保持恒温半小时.
④分离、提纯三颈瓶中粗产品,得到有机产品.
⑤精制产品,得到产品18.72g.
请回答下列问题:
(1)写出制备反应的化学方程式:
 .
.(2)加入原料时,能否最先加入浓硫酸?否.油水分离器的作用是及时分离产物水,促进平衡向生成酯的反应方向移动.
(3)本实验的加热方式宜用水浴加热.如果温度过高,或浓硫酸的量过多,制备产率会减小(填“增大”、“减小”或“不变”).
(4)分离提纯产品:取三颈瓶中混合物加入足量的饱和碳酸钠溶液,分液得到有机层.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”)
(5)产品精制:精制产品的实验装置如图2所示,试分析装置是否合理,不合理(填“合理”或“不合理”),若不合理将如何改进:温度计处在蒸馏烧瓶的支管口处,冷却水应从下口进上口出.(若装置合理,此空不作答).
(6)本实验得到产品的产率为90%.
①H ②O ③Na ④Cl ⑤Li ⑥U ⑦Ca ⑧K ⑨Br ⑩F.
| A. | ①②③④⑦⑧⑨⑩ | B. | ③④⑦⑧⑨⑩ | C. | ①②③④⑥⑦⑧⑨⑩ | D. | ③④⑥⑦⑧⑨⑩ |
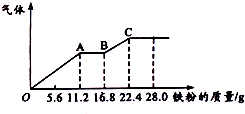 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的最随铁粉质量增加的变化如图所示,下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的最随铁粉质量增加的变化如图所示,下列分析或结果错误的是( )| A. | H2SO4浓度为5mol•L-1 | |
| B. | 第二份溶液中最终溶质为FeSO4 | |
| C. | 每份混合酸中NO3-物质的量为0.2mol | |
| D. | OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| A. | A、需要加热才能进行的化学反应一定是吸热反应 | |
| B. | 化学反应中的能量变化除了热量外还可以是光能、电能等 | |
| C. | 化学反应过程中的能量变化服从能量守恒定律 | |
| D. | 生成物的总能量小于反应物的总能量时发生的是放热反应 |

| A. | 相对于途径①、③,途径②更好地体现了绿色化学思想 | |
| B. | Y可以是葡萄糖溶液 | |
| C. | CuSO4在1100℃所得混合气体X中一定有O2 | |
| D. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:1 |
| A. | 硫酸铅蓄电池的负极:Pb-2e-═Pb2+ | |
| B. | 锌银纽扣电池的正极:Ag2O+2e-+H2O═2AgOH | |
| C. | 碱性锌锰电池的负极:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 氢氧碱性燃料电池的正极:2H2O+4e-═O2+4H+ |
