题目内容
6.关于吸热反应和放热反应,下列说法中错误的是( )| A. | A、需要加热才能进行的化学反应一定是吸热反应 | |
| B. | 化学反应中的能量变化除了热量外还可以是光能、电能等 | |
| C. | 化学反应过程中的能量变化服从能量守恒定律 | |
| D. | 生成物的总能量小于反应物的总能量时发生的是放热反应 |
分析 A.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量,与反应条件无关;
B.根据化学反应中的能量的转化形式;
C.化学反应过程服从能量守恒定律、质量守恒定律;
D.放热反应中,生成物的总能量小于反应物的总能量.
解答 解:A.需要加热才能进行的化学反应不一定是吸热反应,如铝热反应,需要加热,但属于放热反应,故A错误;
B.化学反应中的能量变化除了热量外还可以是光能、电能等,如燃烧发光、放热,原电池还可以转换成电能,故B正确;
C.化学反应过程中的能量变化服从能量守恒定律,质量上服从质量守恒定律,故C正确;
D.生成物的总能量小于反应物的总能量时发生的反应是放热反应,故D正确.
故选A.
点评 本题考查了化学反应中的能量变化以以及原因,完成此题,可以依据已有的知识进行.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| C. | 向FeBr2溶液中通入等物质的量的氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O |
14.下列说法正确的是( )
| A. | 氨水加水稀释后,溶液中所有的离子浓度都减小 | |
| B. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| C. | 常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,则该反应的△H<0 | |
| D. | 相同条件下,Na2CO3溶液的碱性强于C6H5ONa,说明C6H5OH的酸性强于H2CO3 |
1.PCl3可用于半导体生产的外延、扩散工序.有关物质的部分性质如下:
(Ⅰ)制备:
如图是实验室制备PCl3的装置(部分仪器已省略)

(1)仪器乙的名称为冷凝管,其中与自来水进水管连接的编号是b(填“a”或“b”).
(2)实验室常用软锰矿(MnO2)与浓盐酸制备Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)碱石灰的作用是碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度.
(4)向仪器甲中通入干燥的Cl2之前,应先通入一段时间的CO2,其目的是排净装置中的空气,防止空气中的水分和氧气与PCl3反应.
(Ⅱ)提纯:
(5)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到PCl3的纯品.
(Ⅲ)分析:
(6)迅速称取5.5g产品,水解完全后配成500mL溶液,取出25mL,加入过量的0.1mol•L-1碘溶液23mL,充分反应后用0.1mol•L-1Na2S2O3溶液滴定过量的碘,消耗10mLNa2S2O3溶液.
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;
假设测定过程中没有发生其他反应.根据上述数据,可计算出该产品中PCl3的质量分数为90.0%.
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3 2P+5Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)

(1)仪器乙的名称为冷凝管,其中与自来水进水管连接的编号是b(填“a”或“b”).
(2)实验室常用软锰矿(MnO2)与浓盐酸制备Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)碱石灰的作用是碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度.
(4)向仪器甲中通入干燥的Cl2之前,应先通入一段时间的CO2,其目的是排净装置中的空气,防止空气中的水分和氧气与PCl3反应.
(Ⅱ)提纯:
(5)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到PCl3的纯品.
(Ⅲ)分析:
(6)迅速称取5.5g产品,水解完全后配成500mL溶液,取出25mL,加入过量的0.1mol•L-1碘溶液23mL,充分反应后用0.1mol•L-1Na2S2O3溶液滴定过量的碘,消耗10mLNa2S2O3溶液.
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;
假设测定过程中没有发生其他反应.根据上述数据,可计算出该产品中PCl3的质量分数为90.0%.
11.下表给出了六种元素的相关信息,其中A、B、C、D、E为都周期元素.
请根据以上信息回答问题:
(1)A元素符号H F元素的名称铁.
(2)C元素在周期表中的位置第二周期VA族.
(3)D元素原子结构示意图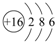 .
.
(4)E元素最高价氧化物对应水化物化学式为NaOH,其含有的化学键类型为离子键、共价键.
(5)B和D对应的气态氢化物中,热稳定性较强的是H2O,熔沸点较高的是H2O.(用具体的化学式表示)
(6)D的最高价含氧酸稀溶液与F单质反应的离子方程式Fe+2H+=Fe2++H2↑.
| 元素 | 相 关 信 息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝. |
| D | 室温下其单质呈淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂. |
| F | 它是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等. |
(1)A元素符号H F元素的名称铁.
(2)C元素在周期表中的位置第二周期VA族.
(3)D元素原子结构示意图
 .
.(4)E元素最高价氧化物对应水化物化学式为NaOH,其含有的化学键类型为离子键、共价键.
(5)B和D对应的气态氢化物中,热稳定性较强的是H2O,熔沸点较高的是H2O.(用具体的化学式表示)
(6)D的最高价含氧酸稀溶液与F单质反应的离子方程式Fe+2H+=Fe2++H2↑.
15.下列物质中,不属于弱电解质的是( )
| A. | CH3CHO | B. | H2CO3 | C. | CH3COOH | D. | H2C2O4 |
16.下列关于苯酚的叙述中不正确的是( )
| A. | 苯酚显弱酸性,它能与氢氧化钠溶液反应 | |
| B. | 在苯酚钠溶液中通入二氧化碳气体,可得到苯酚 | |
| C. | 除去苯中混有的少量苯酚,可用溴水作试剂 | |
| D. | 苯酚有毒,但药皂中掺有少量苯酚 |

 B.
B.
 D.
D.