题目内容
1. (2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:
(2-羟基-4-苯基丁酸乙酯)是制备某药物的中间体,常温下是一种无色透明的油状液体. 某兴趣小组以2-羟基-4-苯基丁酸和乙醇为原料设计实验制备该物质:已知:
| 乙醇 | 2-羟基-4-苯基丁酸 | 2-羟基-4-苯基丁酸乙酯 | |
| 相对分子质量 | 46 | 180 | 208 |
| 状态 | 无色液体 | 白色固体 | 无色液体 |
| 沸点/℃ | 78.4 | 356.9 | 212 |
| 密度/g/cm3 | 0.789 | 1.219 | 1.075 |
| 溶解性 | 易溶于水、有机溶剂 | 能溶于水,易溶于有机溶剂 | 难溶于水,易溶于有机溶剂 |

实验步骤:
①按如图1装置连接仪器
②将18.00g 2-羟基-4-苯基丁酸加入三颈瓶中,加入20mL无水乙醇和适量浓硫酸,再加入几块沸石.
③加热至70℃左右保持恒温半小时.
④分离、提纯三颈瓶中粗产品,得到有机产品.
⑤精制产品,得到产品18.72g.
请回答下列问题:
(1)写出制备反应的化学方程式:
 .
.(2)加入原料时,能否最先加入浓硫酸?否.油水分离器的作用是及时分离产物水,促进平衡向生成酯的反应方向移动.
(3)本实验的加热方式宜用水浴加热.如果温度过高,或浓硫酸的量过多,制备产率会减小(填“增大”、“减小”或“不变”).
(4)分离提纯产品:取三颈瓶中混合物加入足量的饱和碳酸钠溶液,分液得到有机层.在本实验分离过程中,产物应该从分液漏斗的下口放出(填“上口倒出”或“下口放出”)
(5)产品精制:精制产品的实验装置如图2所示,试分析装置是否合理,不合理(填“合理”或“不合理”),若不合理将如何改进:温度计处在蒸馏烧瓶的支管口处,冷却水应从下口进上口出.(若装置合理,此空不作答).
(6)本实验得到产品的产率为90%.
分析 (1)2-羟基-4-苯基丁酸和乙醇在浓硫酸催化作用下水浴加热反应生成2-羟基-4-苯基丁酸乙酯,依据酯化反应的实质是酸脱羟基,醇脱氢写出化学方程式;
(2)原料加入依据先加入密度小的再加入密度大的液体;2-羟基-4-苯基丁酸于三颈瓶中,加入适量浓硫酸和20mL无水乙醇发生的是酯化反应,存在化学平衡,油水分离器的作用及时分离生成的水,促进平衡正向进行分析;
(3)依据反应需要可知温度70°C,加热方式是水浴加热;
(4)2-羟基-4-苯基丁酸乙酯的密度为1.075,据此分析;
(5)依据蒸馏装置和原理分析判断装置图中存在的问题;
(6)根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)2-羟基-4-苯基丁酸和乙醇在浓硫酸催化作用下水浴加热反应生成2-羟基-4-苯基丁酸乙酯和水,依据酯化反应的实质是酸脱羟基、醇脱氢,该反应的化学方程式为 ,
,
故答案为: ;
;
(2)原料加入依据先加入密度小的再加入密度大的液体,所以浓硫酸应最后加入,防止浓硫酸使有机物脱水,被氧化等副反应发生,防止乙醇和酸在浓硫酸溶解过程中放热而挥发;2-羟基-4-苯基丁酸于三颈瓶中,加入适量浓硫酸和20mL无水乙醇发生的是酯化反应,存在化学平衡,油水分离器的作用及时分离生成的水,促进平衡正向进行分析,
故答案为:否;及时分离产物水,促进平衡向生成酯的反应方向移动;
(3)依据反应需要可知温度70°C,需要用温度计控制水浴的温度,所以加热方式是水浴加热,如果温度过高,或浓硫酸的量过多,制备产率会导致产率减小,
故答案为:水浴加热;减小;
(4)2-羟基-4-苯基丁酸乙酯的密度为1.075,比水大,所以分液时2-羟基-4-苯基丁酸乙酯在下层,所以产物应该从分液漏斗的下口放出,
故答案为:下口放出;
(5)依据蒸馏装置和原理分析判断装置图中存在的问题,分析装置图不合理,其中温度计位置错误,冷凝管水流方向错误,应使温度计处在蒸馏烧瓶的支管口处,冷却水应从下口进上口出,
故答案为:不合理;温度计处在蒸馏烧瓶的支管口处,冷却水应从下口进上口出;
(6)根据方程式 可知,18.00g 2-羟基-4-苯基丁酸理论上可产生2-羟基-4-苯基丁酸乙酯的质量为$\frac{18}{180}×208$g=20.8g,所以2-羟基-4-苯基丁酸乙酯的产率为$\frac{18.72g}{20.8g}$×100%=90%,故答案为:90%.
可知,18.00g 2-羟基-4-苯基丁酸理论上可产生2-羟基-4-苯基丁酸乙酯的质量为$\frac{18}{180}×208$g=20.8g,所以2-羟基-4-苯基丁酸乙酯的产率为$\frac{18.72g}{20.8g}$×100%=90%,故答案为:90%.
点评 本题考查了有机物的实验制备装置分析及原理应用,主要是酯化反应原理和实验过程的分析判断,掌握原理和基础是关键,题目难度中等.

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案| A. | NaHSO4显强酸性,因此从组成上分类它应该属于酸 | |
| B. | 含Fe元素质量分数为70%的Fe2O3是纯净物 | |
| C. | CuSO4•5H2O是混合物 | |
| D. | 显碱性的物质一定为碱 |
| A. | 环己烯 | B. | 碘化钾溶液 | C. | 环己烷 | D. | 酒精 |
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| C. | 向FeBr2溶液中通入等物质的量的氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O |
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. |  3-丁醇 3-丁醇 | ||
| C. |  间甲基苯酚 间甲基苯酚 | D. |  1,3,5-三甲基苯 1,3,5-三甲基苯 |
| 元素 | 相 关 信 息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝. |
| D | 室温下其单质呈淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂. |
| F | 它是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等. |
(1)A元素符号H F元素的名称铁.
(2)C元素在周期表中的位置第二周期VA族.
(3)D元素原子结构示意图
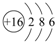 .
.(4)E元素最高价氧化物对应水化物化学式为NaOH,其含有的化学键类型为离子键、共价键.
(5)B和D对应的气态氢化物中,热稳定性较强的是H2O,熔沸点较高的是H2O.(用具体的化学式表示)
(6)D的最高价含氧酸稀溶液与F单质反应的离子方程式Fe+2H+=Fe2++H2↑.
