题目内容
18.向20mL2mol/LAlCl3溶液中加入30mLNaOH溶液,充分反应后得0.78g沉淀,则NaOH溶液的物质的量浓度为( )| A. | 3mol/L | B. | 2mol/L | C. | 4mol/L | D. | 5mol/L |
分析 20mL 2mol/L的AlCl3溶液中氯化铝的物质的量=0.02L×2mol/L=0.04mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.04mol×78g/mol=3.12g>0.78g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液物质的量浓度.
解答 解:20mL 2mol/L的AlCl3溶液中氯化铝的物质的量=0.02L×2mol/L=0.04mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.04mol×78g/mol=3.12g>0.78g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
生成氢氧化铝的物质的量为$\frac{0.78g}{78g/mol}$=0.01mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.01mol×3=0.03mol,
加入NaOH溶液的物质的量浓度为$\frac{0.03mol}{0.03L}$=1mol/L;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.04mol 0.12mol 0.04mol
溶解的氢氧化铝为0.04mol-0.01mol=0.03mol
Al(OH)3+OH-═AlO2-+2H2O
0.03mol 0.03mol
则消耗的碱的物质的量为0.12mol+0.03mol=0.15mol,
加入NaOH溶液的物质的量浓度为$\frac{0.15mol}{0.03L}$=5mol/L,
故选:D.
点评 本题考查方程式的有关计算,题目难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.

 阅读快车系列答案
阅读快车系列答案| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 进行石油分馏操作时,加入碎瓷片 |
| A. | 钠最多 | B. | 一样多 | C. | 铁最多 | D. | 铝最多 |
| A. | Al3+、S2-、Na+、Cl- | B. | K+、Fe3+、S2-、OH- | ||
| C. | Ba2+、HCO3-、Fe3+、H+ | D. | Na+、Al3+、SO42-、NO3- |

| A. | 该化合物可以发生水解反应 | B. | 该化合物能发生银镜反应 | ||
| C. | 该化合物能使酸性KMnO4溶液褪色 | D. | 该化合物共含有四种官能团 |
(1)磁铁矿的主要成分是Fe3O4,其中铁元素的化合价为+2、+3.
(2)采用很多方法可以鉴别Fe2+和Fe3+的溶液,下表是其中某些方法,补全下表中所缺的现象.
| 鉴别方法 | Fe2+ | Fe3+ |
| 直接观察色 | 浅绿色 | 棕黄色 |
| 与KSCN溶液 | 无现象 | 血红色 |
| 金属 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
②若铜粉中混有Mg,提纯Cu时可用盐酸(填名称)除去Mg.
③Ti(钛)在化合物中的化合价为+4价,试写出Ti(钛)与盐酸反应的离子方程式Ti+4H+═Ti4++2H2↑.
④冶炼Ti(钛)的反应为TiO2+Cl2+2C═TiCl4+2X,其中X的化学式为CO.
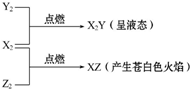 常温、常压下X2、Y2、Z2三种气体有如图转化关系:
常温、常压下X2、Y2、Z2三种气体有如图转化关系: