题目内容
10.从植物中分离出的化合物 zeylastral 的结构简式如图所示,下列说法不正确的是( )
| A. | 该化合物可以发生水解反应 | B. | 该化合物能发生银镜反应 | ||
| C. | 该化合物能使酸性KMnO4溶液褪色 | D. | 该化合物共含有四种官能团 |
分析 有机物含有酚羟基,可发生取代、氧化和显色反应,含有醛基,可发生加成、氧化反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有酯基,可发生水解反应,以此解答该题.
解答 解:A.含有酯基,可发生水解反应,故A正确;
B.含有醛基,可发生银镜反应,故B正确;
C.含有酚羟基和碳碳双键,可被酸性高锰酸钾氧化,故C正确;
D.含有羟基、醛基、碳碳双键、羰基以及酯基,共5种,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力考查,有利于培养学生的良好的科学素养,注意把握有机的组成、结构和性质,难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
1.欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液,弃水层 | |
| B. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| C. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| D. | 乙醇(水):加入新制生石灰,蒸馏,收集馏出物 |
18.向20mL2mol/LAlCl3溶液中加入30mLNaOH溶液,充分反应后得0.78g沉淀,则NaOH溶液的物质的量浓度为( )
| A. | 3mol/L | B. | 2mol/L | C. | 4mol/L | D. | 5mol/L |
5.如图表示4-溴环己烯所发生的4个不同的反应,其中,产物中只含有一种官能团的反应是( )


| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①② |
15.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的p区; 溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF) 2 形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是
碘(填名称).
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II 所示:
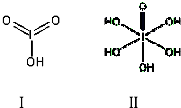
请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)试分析 ClO2-中心氯原子的杂化类型sp3,试写出一个 ClO3-的等电子体Cl2O或OF2.
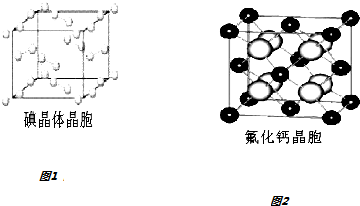
(6)图1为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{a{\;}^{3}ρN{\;}_{A}}{4}$.
(1)卤族元素位于元素周期表的p区; 溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF) 2 形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是
碘(填名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |

请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)试分析 ClO2-中心氯原子的杂化类型sp3,试写出一个 ClO3-的等电子体Cl2O或OF2.
(6)图1为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{a{\;}^{3}ρN{\;}_{A}}{4}$.


 .
. 铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品: