题目内容
NA为阿伏加德罗常数,下列叙述正确的是( )
| A、1L 0.5mol?L-1氨水中所含NH4+数为0.5NA |
| B、1mol Fe与足量氯气反应转移的电子数为2 NA |
| C、标准状况下,33.6L CO2约含有1.5NA个分子 |
D、1 mol  中含碳碳双键数为3 NA 中含碳碳双键数为3 NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.一水合氨为弱电解质,在溶液中不能部分电离出铵根离子;
B.铁与氯气反应生成氯化铁,1mol铁完全反应失去3mol电子;
C.标况下33.6L二氧化碳的物质的量为1.5mol;
D.苯中碳碳键为一种独特键,不存在碳碳双键.
B.铁与氯气反应生成氯化铁,1mol铁完全反应失去3mol电子;
C.标况下33.6L二氧化碳的物质的量为1.5mol;
D.苯中碳碳键为一种独特键,不存在碳碳双键.
解答:
解:A.氨水为弱碱,溶液中一水合氨只能部分电离出铵根离子,无法计算溶液中铵根离子的物质的量,故A错误;
B.1mol铁与足量氯气完全反应生成1mol氯化铁,失去3mol电子,反应转移的电子数为3NA,故B错误;
C.标准状况下,33.6L CO2的物质的量为:
=1.5mol,1.5mol二氧化碳中含有1.5NA个分子,故C正确;
D.苯中碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键,故D错误;
故选C.
B.1mol铁与足量氯气完全反应生成1mol氯化铁,失去3mol电子,反应转移的电子数为3NA,故B错误;
C.标准状况下,33.6L CO2的物质的量为:
| 33.6L |
| 22.4L/mol |
D.苯中碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,选项D需要明确苯中碳碳键为一种独特键.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
在强酸性溶液中能大量共存,并且溶液为无色透明的是( )
| A、NH4+Na+ClO-Al(OH)4- |
| B、K+ Cu2+ Cl- NO3- |
| C、K+ NH4+ Cl- SO42- |
| D、Na+ K+ SiO32- HCO3- |
安全气囊碰撞时发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,下列判断正确的是( )
| A、每生成16 mol N2转移30 mol电子 |
| B、NaN3中N元素被氧化 |
| C、N2既是氧化剂又是还原剂 |
| D、还原产物与氧化产物质量之比为1:15 |
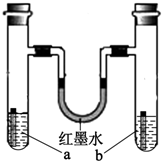 如图装置中,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁片,放置一段时间.下列有关描述错误的是( )
如图装置中,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁片,放置一段时间.下列有关描述错误的是( )| A、两块生铁片均发生电化学腐蚀 |
| B、墨水柱两边的液面变为左低右高 |
| C、两试管中相同的电极反应式为Fe-2e-=Fe2+ |
| D、a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
NaCl的摩尔质量是( )
| A、58.5 |
| B、58.5g |
| C、58.5g/mol |
| D、58.5mol |
锂-钒氧化物电池的能量密度远远超过其他材料电池,电池总反应式为xLi+V2O5
LixV2O5,下列说法正确的是( )
| 放电 |
| A、放电时,锂离子向负极移动 |
| B、放电时,负极上反应的物质是锂,正极上反应的物质是V2O5 |
| C、放电时,负极的电极反应为Li-e-=Li+ |
| D、充电时,V2O5在阴极被还原 |
芥子气[(ClCH2CH2)2S是一种毒气,即使嗅觉不能感受的极低浓度也会对人造成伤害,可用Na0H溶液解毒.芥子气可用以下方法制备 2CH2=CH2+S2Cl2→(ClCH2CH2)2S+S下列有关说法正确的是( )
| A、芥子气是直线型分子 |
| B、S2Cl2中有极性键和非极性键 |
| C、制备反应中S2Cl2,作还原剂 |
| D、NaOH溶液解毒原理是中和反应 |
 卡托普列(Captopril)临床用于治疗高血压和充血性心力衰竭.它最有价值的合成路线为:
卡托普列(Captopril)临床用于治疗高血压和充血性心力衰竭.它最有价值的合成路线为: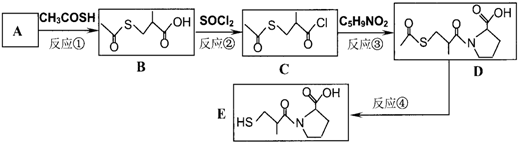
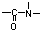 能在碱性条件下水解.则1molE最多能与
能在碱性条件下水解.则1molE最多能与