题目内容
17.下列叙述正确的是( )| A. | 含最高价元素的化合物,一定具有氧化性 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 失电子越多,还原性越强 | |
| D. | 一种物质是氧化剂时,同时必然有另一种物质是还原剂 |
分析 A.处于元素的最高价,只能得到电子;
B.处于中间价的微粒具有氧化性和还原性;
C.还原性与失去电子的能力强;
D.氧化还原反应中氧化剂、还原剂可能为同种物质.
解答 解:A.处于元素的最高价,只能得到电子,如高锰酸钾、硝酸中Mn、N元素为最高价,具有氧化性,故A正确;
B.处于中间价的微粒具有氧化性和还原性,如亚铁离子、亚硫酸根离子,故B错误;
C.还原性与失去电子的能力强,与失去电子的多少无关,如Na的还原性比Al强,故C错误;
D.氧化还原反应中氧化剂、还原剂可能为同种物质,如氯气与NaOH反应,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应基本概念及元素的化合价与微粒性质为解答的关键,注意结合实例分析,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.对于物质的量浓度均为0.01mol/L的①NaHCO3、②Na2CO3、③CH3COOH、④CH3COONa四种溶液,下列说法正确的是( )
| A. | ①的离子浓度为:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | ②c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| C. | ③加入等体积的水稀释,电离平衡正向移动,c(H+)增大 | |
| D. | ④和③等体积混合,c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
5. 1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应:
1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应: 模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
回答下列问题:
(1)已知:①
②
则反应 的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).
的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).
(2)合成氨的平衡常数表达式为$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,平衡时,M点NH3的体积分数为10%,则N2的转化率为18%(保留两位有效数字)
(3)X轴上a点的数值比b点小(填“大”或“小”).上图中,Y轴表示温度(填“温度”或“压强”),判断的理由是随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,故Y为温度.
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如表所示:
下列判断正确的是AB.
A.放出热量:Ql<Q2 B.N2的转化率:I>III
C.平衡常数:II>I D.达平衡时氨气的体积分数:I>II
(5)下列能提高N2的转化率的是C
A.升高温度 B.恒容体系中通入N2气体
C.分离出NH3 D.通入稀有气体He,使体系压强增大到原来的5倍
(6)常温下,向VmL amoI.L-l的稀硫酸溶液中滴加等体积bmol.L-l 的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)>c(S042-)(填“>”、“<”或“=”).
(7)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-.写出负极的电极反应式2NH3+3O2--6e-=N2+3H2O.
 1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应:
1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应: 模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.回答下列问题:
(1)已知:①

②

则反应
 的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).
的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).(2)合成氨的平衡常数表达式为$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,平衡时,M点NH3的体积分数为10%,则N2的转化率为18%(保留两位有效数字)
(3)X轴上a点的数值比b点小(填“大”或“小”).上图中,Y轴表示温度(填“温度”或“压强”),判断的理由是随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)?2NH3(g)△H<0向逆反应方向移动,故Y为温度.
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如表所示:
| 容器编号 | 实验条件 | 平衡时反应中的能量变化 |
| Ⅰ | 恒温恒容 | 放热Q1kJ |
| Ⅱ | 恒温恒压 | 放热Q2kJ |
| Ⅲ | 恒容绝热 | 放热Q3kJ |
A.放出热量:Ql<Q2 B.N2的转化率:I>III
C.平衡常数:II>I D.达平衡时氨气的体积分数:I>II
(5)下列能提高N2的转化率的是C
A.升高温度 B.恒容体系中通入N2气体
C.分离出NH3 D.通入稀有气体He,使体系压强增大到原来的5倍
(6)常温下,向VmL amoI.L-l的稀硫酸溶液中滴加等体积bmol.L-l 的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)>c(S042-)(填“>”、“<”或“=”).
(7)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-.写出负极的电极反应式2NH3+3O2--6e-=N2+3H2O.
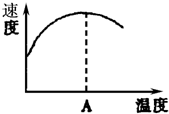 酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.
酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.