题目内容
10.下列对元素Na、Cl、O的推测不正确的是( )| A. | 同周期元素中Na的金属性最强 | B. | 原子半径Na>O,离子半径O2->Na+ | ||
| C. | 同族元素中O的氢化物稳定性最高 | D. | 同族元素中Cl的氢化物沸点最高 |
分析 A.同一周期元素,从左到右金属性逐渐减弱;
B.电子层越多原子半径越大,电子层相同时原子序数越大,离子半径越小;
C.同主族从上到下元素的非金属性减弱,其氢化物的稳定性减弱;
D.同主族氢化物的相对分子质量越大,沸点越高,含有氢键的沸点较高.
解答 解:A.同一周期元素,从左到右金属性逐渐减弱,所以第三周期中Na的金属性最强,故A正确;
B.电子层越多原子半径越大,则原子半径Na>O,电子层相同时原子序数越大,离子半径越小,则离子半径O2->Na+,故B正确;
C.同主族从上到下元素的非金属性减弱,其氢化物的稳定性减弱,所以第VIA族中O的氢化物稳定性最高,故C正确;
D.同主族氢化物的相对分子质量越大,沸点越高,含有氢键的沸点较高,HF分子间存在氢键,所以同族元素中F的氢化物沸点最高,故D错误.
故选D.
点评 本题考查元素周期律知识,注意把握元素周期律的递变规律,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
20.化学在生产和日常生活中有着重要的应用.下列叙述正确的是( )
| A. | 钢铁设备与直流电源正极相连可防腐 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫不能用勒夏特列原理解释 | |
| D. | 废旧电池中的汞、锅、铅等重金属盐对土壤和水源会造成污染 |
1.下列叙述正确的是( )
| A. | 化学反应一定只伴随热量的变化 | |
| B. | 凡是吸热或放热过程中热量的变化均称为反应热 | |
| C. | 若△H<0,则反应物的能量高于生成物的能量 | |
| D. | 若△H>0,则反应物的能量高于生成物的能量 |
18.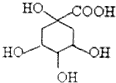 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中不正确的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中不正确的是( )
 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中不正确的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中不正确的是( )| A. | 不能使溴的四氯化碳溶液褪色 | |
| B. | 能用碳酸氢钠溶液鉴别奎尼酸和苯 | |
| C. | 1 mol奎尼酸与足量钠反应生成56L氢气 | |
| D. | 与乙醇、乙酸均能发生取代反应 |
5.下列各组物质中,互为同系物的是( )
| A. | CH2=CHCH2CH3和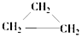 | B. |  和 和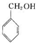 | ||
| C. | 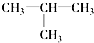 和CH3CH2CH2CH3 和CH3CH2CH2CH3 | D. | CH3CH2Cl与CH3CH2CH2Cl |
15.下列物质中只含有氯分子的是( )
| A. | 液氯 | B. | 氯水 | C. | 盐酸 | D. | 氯化铁 |
2.下列离子方程式与所述事实相符且书写正确的是( )
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 高锰酸钾在酸性介质中与草酸反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8 H2O | |
| C. | FeCl2与K3[Fe(CN)6]反应:2Fe2++3[Fe(CN)6]3-═Fe2[Fe(CN)6]3↓ | |
| D. | 向KI和H2SO4的混合溶液中通入空气:4H++4I-+O2=2I2+2H2O |
19.将7g某铜、银合金与足量的a mol/L HNO3充分反应,完全溶解后放出的气体与标准状况下的氧气0.56L混合,通入水中恰好完全吸收,则此合金中铜的质量是( )
| A. | 1.6 g | B. | 2.4 g | C. | 3.2 g | D. | 4.8 g |
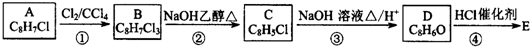
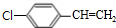 ,B中含有的官能团是氯原子.
,B中含有的官能团是氯原子.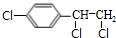 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$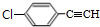 +2NaCl+2H2O,其反应类型为消去反应.
+2NaCl+2H2O,其反应类型为消去反应.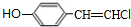 ;
;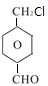 、
、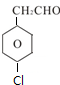 .
.