题目内容
15.下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | Mg3Cl2+2NaOH═Mg(OH)2↓+2NaCl | ||
| C. | 2NaOH+Cl2═NaOCl+H2O | D. | NH4Cl+NaO═NaCl+NH3↑+H2O |
分析 一般金属元素与非金属元素形成离子键,同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键,以此来解答.
解答 解:A.2Na2O2+2H2O=4NaOH+O2↑中有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成,故A选;
B.该反应中没有非极性键的断裂和形成,故B不选;
C.该反应中没有非极性键的形成,故C不选;
D.该反应中没有非极性键的断裂和形成,故D不选;
故选A.
点评 本题考查化学键和化学反应,明确化学反应的实质为旧键断裂和新键形成及常见物质中的化学键即可解答,注意利用化学键判断的一般规律,题目难度中等.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
16.下列物质一定属于同系物的是( )
① ②
② ③
③ ④C2H4
④C2H4
⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦ ⑧
⑧
①
 ②
② ③
③ ④C2H4
④C2H4⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦
 ⑧
⑧
| A. | ①和② | B. | ④和⑥ | C. | ④和⑧ | D. | ⑦和⑧ |
10. 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.
回答下列问题:
(1)D的元素名称是磷,H的元素符号是B.
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物J2A2的电子式是: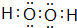 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.
(3)若将标况下E的单质3.36L与通入到100mL 2mol/L的FeBr2溶液中,反应的离子方程式3Cl2+4Fe2++2Br-=6Cl-+4Fe3++Br2
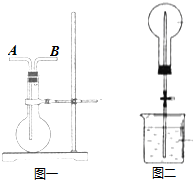
(4)G的氢化物是一种极易溶于水的气体.若用图1所示装置来收集此气体并完成喷泉实验,则气体应从图一的B口进入烧瓶(填字母).烧瓶内收集气体完成后,经测定瓶内气体的密度是相同条件下氢气密度的10.5倍,将此烧瓶按图二完成喷泉实验,请说明引发喷泉的方法用热毛巾将烧瓶捂热,NH3受热膨胀,赶出玻璃导管内的空气和水,NH3与水接触,即发生喷泉.实验完后液体将上升到容器容积的$\frac{2}{3}$.
(5)在Fe(GO3)2溶液中加入稀硫酸,溶液变成了黄色,有关反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(6)甲同学认为I的氧化物IO2与Na2O2反应类似于CO2与Na2O2的反应,该反应的化学方程式是2Na2O2+2SO2=2Na2SO3+O2.乙同学认为也有可能部分IO2被Na2O2氧化了,因此固体产物应该是混合物,为了检验是否有氧化产物生成,他们设计了如下方案:

上述方案是否合理?不合理.请简要说明两点理由:
①若反应后的固体中还残留有Na2O2,则溶于水后,残留的Na2O2会将SO32-氧化为SO42-;
②即使Na2O2已完全反应,加入的稀硝酸也能将BaSO3氧化为BaSO4.
 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
(1)D的元素名称是磷,H的元素符号是B.
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物J2A2的电子式是:
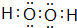 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.(3)若将标况下E的单质3.36L与通入到100mL 2mol/L的FeBr2溶液中,反应的离子方程式3Cl2+4Fe2++2Br-=6Cl-+4Fe3++Br2
(4)G的氢化物是一种极易溶于水的气体.若用图1所示装置来收集此气体并完成喷泉实验,则气体应从图一的B口进入烧瓶(填字母).烧瓶内收集气体完成后,经测定瓶内气体的密度是相同条件下氢气密度的10.5倍,将此烧瓶按图二完成喷泉实验,请说明引发喷泉的方法用热毛巾将烧瓶捂热,NH3受热膨胀,赶出玻璃导管内的空气和水,NH3与水接触,即发生喷泉.实验完后液体将上升到容器容积的$\frac{2}{3}$.
(5)在Fe(GO3)2溶液中加入稀硫酸,溶液变成了黄色,有关反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(6)甲同学认为I的氧化物IO2与Na2O2反应类似于CO2与Na2O2的反应,该反应的化学方程式是2Na2O2+2SO2=2Na2SO3+O2.乙同学认为也有可能部分IO2被Na2O2氧化了,因此固体产物应该是混合物,为了检验是否有氧化产物生成,他们设计了如下方案:

上述方案是否合理?不合理.请简要说明两点理由:
①若反应后的固体中还残留有Na2O2,则溶于水后,残留的Na2O2会将SO32-氧化为SO42-;
②即使Na2O2已完全反应,加入的稀硝酸也能将BaSO3氧化为BaSO4.
7.甲、乙两个研究性学习小组拟从实验室含碘废液中回收碘.制订两种方案提取,他们的实验方案如下:
(甲小组实施的为方案一,乙小组实施的为方案二)
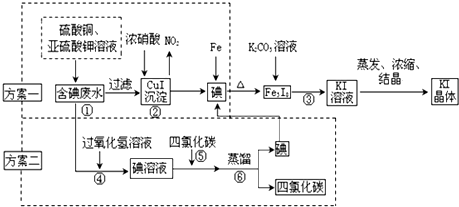
I.CuI在酸性介质中采用FeCl3氧化成即可生成单质碘.请写出上述化学反应方程式2CuI+4Fe3+═4Fe2++2Cu2++I2↓.
Ⅱ.蒸馏时用到的玻璃仪器,除接受器、锥形瓶、酒精灯外,还缺少的玻璃仪器有蒸馏烧瓶、冷凝器、温度计.
Ⅲ.甲小组为测定含碘废水中碘的含量.进行了以下实验操作:
A.各取1000g实验室废水,进行以上操作后,将所得KI晶体溶于适量水中配置成100mL溶液;
B.取KI溶液20mL于锥形瓶中;
C.用稀硫酸酸化所得KI溶液,加入足量KIO3溶液,使KIO3与KI反应完全;
D.以淀粉为指示剂,逐滴加入物质的量浓度为0.3mol•L-1的Na2S2O3溶液20.0mL,恰好反应完全.
已知:I2+2S2O32-=2I-+S4O62-;
(1)请写出步骤 C 中的离子反应方程式.5I-+IO3-+6H+=3I2↓+3H2O
(2)该废液中碘的质量分数为0.32%.
Ⅳ.(1)步骤③中的操作名称为过滤,通过该步操作还得到另一黑色固体物质.
(2)乙小组同学针对该黑色物质的成分,进行了如下步骤进行定性分析:
①在进行步骤四前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液自身可作指示剂.
②通过以上步骤进行分析,该黑色物质可能为Fe3O4.
(甲小组实施的为方案一,乙小组实施的为方案二)

I.CuI在酸性介质中采用FeCl3氧化成即可生成单质碘.请写出上述化学反应方程式2CuI+4Fe3+═4Fe2++2Cu2++I2↓.
Ⅱ.蒸馏时用到的玻璃仪器,除接受器、锥形瓶、酒精灯外,还缺少的玻璃仪器有蒸馏烧瓶、冷凝器、温度计.
Ⅲ.甲小组为测定含碘废水中碘的含量.进行了以下实验操作:
A.各取1000g实验室废水,进行以上操作后,将所得KI晶体溶于适量水中配置成100mL溶液;
B.取KI溶液20mL于锥形瓶中;
C.用稀硫酸酸化所得KI溶液,加入足量KIO3溶液,使KIO3与KI反应完全;
D.以淀粉为指示剂,逐滴加入物质的量浓度为0.3mol•L-1的Na2S2O3溶液20.0mL,恰好反应完全.
已知:I2+2S2O32-=2I-+S4O62-;
(1)请写出步骤 C 中的离子反应方程式.5I-+IO3-+6H+=3I2↓+3H2O
(2)该废液中碘的质量分数为0.32%.
Ⅳ.(1)步骤③中的操作名称为过滤,通过该步操作还得到另一黑色固体物质.
(2)乙小组同学针对该黑色物质的成分,进行了如下步骤进行定性分析:
| 步骤 | 操作 | 现象 |
| 一 | 取黑色物质于烧杯中,加适量水进行洗涤、干燥 | 黑色物质未溶解 |
| 二 | 取适量固体于稀硫酸中进行充分溶解 | 无气体生成 |
| 三 | 移取少量步骤二溶液于试管A中,并滴加硫氰化钾溶液 | 溶液为血红色 |
| 四 | 移取少量步骤二溶液于试管B中,滴加酸性KMnO4溶液 | 酸性KMnO4溶液褪色 |
②通过以上步骤进行分析,该黑色物质可能为Fe3O4.
4.下列物质中属于晶体的是( )
| A. | 橡胶 | B. | 玻璃块 | C. | 水晶 | D. | 淀粉 |
 中含有苯环的所有同分异构体
中含有苯环的所有同分异构体
 (写结构简式).
(写结构简式). 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件: (写出一个就可以)
(写出一个就可以) .
.