题目内容
20.根据要求完成下列问题(1)写出
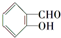 中含有苯环的所有同分异构体
中含有苯环的所有同分异构体
(2)C7H5O2Cl的同分异构体中含有苯环且Cl直接和苯环相接能发生银镜反应的共有13种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2:2:1的是
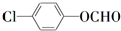 (写结构简式).
(写结构简式).(3)
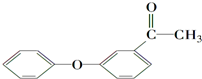 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件:Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应.
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环.
写出该同分异构体的结构简式:
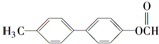 (写出一个就可以)
(写出一个就可以)(4)某有机物X(C4H6O5)广泛存在于许多水果内,尤其以苹果、葡萄、西瓜、山楂为多.该化合物具有如下性质:①1molX与足量金属钠反应产生1.5mol气体;②在有浓H2SO4和加热条件下,X与醇或羧酸均反应生成有香味的产物;③X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应.
根据上述信息,写出有机物X 可能的结构简式:HOOCCH(OH)CH2COOH、(HOOC)2C(OH)CH3 (至少写出两种)
分析 (1)根据官能团位置异构以及官能团异构来解答;
(2)C7H5O2Cl的同分异构体中含有苯环且Cl直接和苯环相接能发生银镜反应,说明分子中含有苯环、氯原子、醛基、羟基或酯基(甲酸某酯),可以看成苯环的二元取代产物或三元取代产物,有2个取代基时,有邻、间、对三不同结构;
根据核磁共振氢谱有三种不同化学环境的氢,说明有3种氢原子,峰面积之比等于个数之比以及含有醛基、羟基或酯基(甲酸某酯)来解答.
(3)根据能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应,说明含有酯基,且水解后得到酚羟基以及分子中等效氢的判断来解答;
(4)有机物X的分子式为C4H6O5,不饱和度为2,在有浓H2SO4和加热条件下,X与醇或羧酸均反应生成有香味的产物,说明该有机物分子中含有羧基和羟基;X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应,说明分子中羟基邻位碳上有氢原子;1molX与足量金属钠反应产生1.5mol气体,结合不饱和度以及氧原子守恒可知有机物分子中含有2个羧基和1个羟基,据此解答.
解答 解:(1) 中醛基和羟基可以处于间位、对位,当然还可以形成其他官能团羧基、酯基,所以含有苯环的所有同分异构体为:
中醛基和羟基可以处于间位、对位,当然还可以形成其他官能团羧基、酯基,所以含有苯环的所有同分异构体为: ;
;
故答案为: ;
;
(2)C7H5O2Cl的同分异构体中含有苯环且Cl直接和苯环相接能发生银镜反应,说明分子中含有苯环、氯原子、醛基、羟基或酯基(甲酸某酯),当分子中含有氯原子,酯基(甲酸某酯),有2个取代基时,有邻、间、对三不同结构,所以有3种结构;
当分子中含有氯原子,醛基、羟基,先考虑有2个取代基时,有邻、间、对三不同结构,所以有3种结构: ,
,
再用醛基取代1个氢原子,其结构分别有:4种,4种,2种,共10种;
所以符合条件的共有13种;
某物质的分子式为C7H5O2Cl,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积之比为2:2:1,含有含有醛基、羟基或酯基(甲酸某酯)的结构简式为: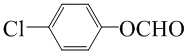 ;
;
故答案为:13; ;
;
(3)能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应,说明含有酯基,且水解后得到酚羟基,分子中有6种不同化学环境的氢,且分子中含有两个苯环,则该化合物的同分异构体的结构简式可能为: ;
;
故答案为: ;
;
(4)有机物X的分子式为C4H6O5,不饱和度为2,在有浓H2SO4和加热条件下,X与醇或羧酸均反应生成有香味的产物,说明该有机物分子中含有羧基和羟基;X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应,说明分子中羟基邻位碳上有氢原子;1molX与足量金属钠反应产生1.5mol气体,结合不饱和度以及氧原子守恒可知有机物分子中含有2个羧基和1个羟基,X 可能的结构简式:HOOCCH(OH)CH2COOH、(HOOC)2C(OH)CH3;
故答案为:HOOCCH(OH)CH2COOH、(HOOC)2C(OH)CH3.
点评 本题考查了有机物分子式、同分异构体的确定、结构简式的推断,注意核磁共振氢谱、官能团性质的运用,难度中等.

| 编号 | 操作 | 实验现象 |
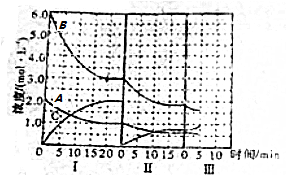
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴等浓度 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡;试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
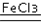 2H2O+O2↑.
2H2O+O2↑.(2)实验①的目的是研究温度对H2O2分解速率的影响.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率 (用实验中提供的试剂).
(4)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
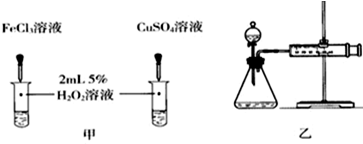
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | Mg3Cl2+2NaOH═Mg(OH)2↓+2NaCl | ||
| C. | 2NaOH+Cl2═NaOCl+H2O | D. | NH4Cl+NaO═NaCl+NH3↑+H2O |
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 已知NH4F水溶液中含有HF分子,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 |
| A. | S(g)+O2(g)=SO2(g)放出热量大于297.23kJ | |
| B. | S(g)+O2(g)=SO2(g)放出热量小于297.23kJ | |
| C. | △H=-297.23kJ•mol-1表示固体S的燃烧热 | |
| D. | 形成1molSO2化学键释放的总能量大于断裂1molS(s)和1molO2(g)化学键吸收的总能量 |
| A. | 氯原子的结构示意图为  | |
| B. | 质量数为37的氯原子${\;}_{17}^{37}$Cl | |
| C. | 氯化镁的电子式:Mg2+[Cl]2 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
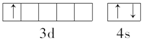 ,该元素基态原子结构示意图
,该元素基态原子结构示意图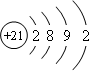 .该元素的名称为钪,形成的单质为金属晶体.
.该元素的名称为钪,形成的单质为金属晶体. 中心原子的杂化方式为
中心原子的杂化方式为