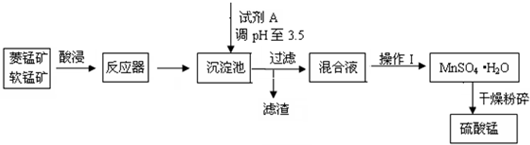
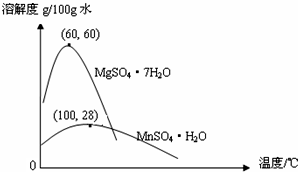
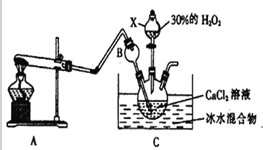
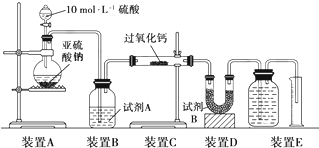
题目内容
15.对于反应A(g)+3B(g)═4C(g)+2D(g),在相同时间内,用不同物质表示的平均反应速率如下,则反应速率最快的是( )| A. | v(A)=0.4 mol/(L•s) | B. | v(B)=0.8 mol/(L•s) | C. | v(C)=1.2 mol/(L•s) | D. | v(D)=0.7 mol/(L•s) |
分析 反应速率之比等于化学计量数之比,根据反应方程式,把不同物质的反应速率换算成同一物质的反应速率进行比较.
解答 解:同一反应中各物质的反应速率之比等于化学计量数之比,根据反应A(g)+3B(g)═4C(g)+2D(g),把这些反应速率都换算成A的反应速率.
A.v(A)=0.4 mol/(L•s)
B.V(A)=$\frac{0.8}{3}$mol/(L•s)
C.V(A)=$\frac{1.2}{4}$ mol/(L•s)
D.V(A)=$\frac{0.7}{2}$mol/(L•s);所以反应速率大小顺序是A>D>C>B,反应速率最快的是A,
故选:A.
点评 本题考查化学反应速率快慢比较,明确化学反应速率与计量数关系是解本题关键,化学反应中,可以用不同的物质来表示这一反应的反应速率,数值可能不同但表示的意义相同,注意单位是否相同,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
19.苹果酸的结构简式为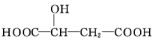 ,下列说法正确的是( )
,下列说法正确的是( )
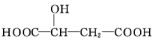 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸不能发生聚合反应 | |
| B. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| C. | 苹果酸分子的核磁共振氢谱有四组峰,峰面积之比为1:1:2:2 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
20.短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素;Z原子的最外层电子数是其最内层电子数的$\frac{1}{2}$;W的最高正价和最低负价的代数和为0,下列说法正确的是( )
| A. | 原子半径:X<Y<Z<W | |
| B. | Z的氢化物中只含离子键 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应 |
20.下列实验操作中错误的是( )
①蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
②过滤操作中,不能用玻璃棒搅拌加快过滤速度
③分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大.
①蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
②过滤操作中,不能用玻璃棒搅拌加快过滤速度
③分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大.
| A. | ②③ | B. | ①③ | C. | ①② | D. | ①④ |
7.下列有关化学用语表示正确的是( )
| A. | 硫化钠的电子式: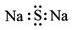 | B. | 中子数为10的氧原子:${\;}_8^{10}O$ | ||
| C. | 硫离子的结构示意图: | D. | HC1O的结构式:H-O-Cl |
4.下列有关化学键的叙述,正确的是( )
| A. | 仅含有共价键的物质定是共价化合物 | |
| B. | 单质分子中均存在化学键 | |
| C. | 离子化合物中一定含有离子键,可能含有配位键和共价键 | |
| D. | 由不同种非属元素的原子形成的共价化合物一定只含极性键 |
5.有机物E的名称是( )
| A. | 丁烷 | B. | 2-甲基丙烷 | C. | 1-甲基丙烷 | D. | 甲烷 |