题目内容
7.1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的微粒,互称为等电子体.等电子体的结构相似、物理性质相近.根据上述原理,下列微粒中,不互为等电子体的是( )| A. | N2 和 CO | B. | CO2 和 N2O | C. | O3 和 CO2 | D. | CO32- 和 NO3- |
分析 根据题意:原子数相同,电子总数相同的分子,互称为等电子体,依据标在元素符号右下角的数字表示一个分子中所含原子的个数;如CO2 中含有3个原子,CO中含有2个原子,进行分析解答本题.
解答 解:A.N2、CO中原子数相同,N2电子总数为 7×2=14,CO中电子数为:6+8=14,故A不选;
B.CO2 和 N2O分子中原子数相同,电子数也相同,均是22个,B不选;
C.O3 和 CO2中原子数相同,电子数不相同,分别是24和22个,C选;
D.CO32- 和 NO3-中原子数相同,电子数均为32个,D不选;
故选C.
点评 本题考查“等电子原理”的应用,注意掌握原子组成与结构是解题的关键,题目难度不大.

练习册系列答案
相关题目
10.设NA为阿伏加德罗常数,下列有关叙述正确的是( )
| A. | 1 molN2与4 mol H2在一定条件下反应生成NH3的分子数为2NA | |
| B. | 标准状况下,5.6LSO3中含有的原子总数为NA | |
| C. | 1 molCu和足量的硫粉加热反应转移的电子数是2NA | |
| D. | 常温下,4.6g NO2 和N2O4的混合物中氧原子数为0.2NA |
8. 铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①2Fe2O3(s)+3C(s)?4Fe(s)+3CO2(g)△H=+460.5kJ•mol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1
③断裂1mol CO(s)气体中的化学键需要吸收1076kJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490kJ的能量
请回答下列问题:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为834.5kJ.
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a mol•L-1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b mol•L-1,则a=b.(选填“>”“<”或“=”)
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
①T2℃时,容器1中反应的平衡常数K1=64.
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)=0.048mol/(L•min).
③对于三个容器中的反应,下列说法正确的是CD(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率a1<a2.
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图所示.
6min时,改变的外界条件为升温,理由为升温,平衡逆向移动,CO浓度增大,CO2浓度减小.
 铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:①2Fe2O3(s)+3C(s)?4Fe(s)+3CO2(g)△H=+460.5kJ•mol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1
③断裂1mol CO(s)气体中的化学键需要吸收1076kJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490kJ的能量
请回答下列问题:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为834.5kJ.
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a mol•L-1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b mol•L-1,则a=b.(选填“>”“<”或“=”)
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)=0.048mol/(L•min).
③对于三个容器中的反应,下列说法正确的是CD(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率a1<a2.
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图所示.
6min时,改变的外界条件为升温,理由为升温,平衡逆向移动,CO浓度增大,CO2浓度减小.
12.下列关于铁元素的叙述中正确的是( )
| A. | 2Fe3++Cu=2Fe2++Cu2+成立说明氧化性:Fe3+>Cu2+ | |
| B. | 25℃,pH=0的溶液中,Al3+、NH4+、NO3-、Fe2+可以大量共存 | |
| C. | 5.6g铁与足量的氯气反应失去电子为0.2mol | |
| D. | 硫酸铁溶液中加入铁粉,滴加KSCN溶液一定不变血红色 |
19.下列物质不是胶体的是( )
| A. | 淀粉溶液 | B. | 酒精溶液 | C. | 豆浆溶液 | D. | 鸡蛋清溶液 |
16.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+、K+、NO3-、Cl- | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Cu2+、Na+、SO42-、OH- | D. | Ba2+、SO32-、NO3-、K+ |
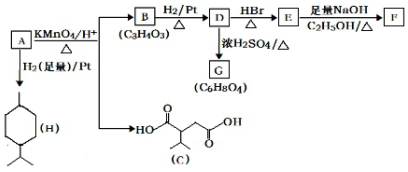
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$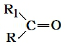 +R2COOH
+R2COOH .
. .
. .
.
 如图,标准状况下,向带有活塞最大容积为120L的密闭容器中充入a mol H2S和b mol SO2(a、b为正整数;a≤5,b≤5),则反应完全后,容器内气体可能达到的最大密度(g/L)是( )
如图,标准状况下,向带有活塞最大容积为120L的密闭容器中充入a mol H2S和b mol SO2(a、b为正整数;a≤5,b≤5),则反应完全后,容器内气体可能达到的最大密度(g/L)是( )