题目内容
2.下列实验操作合理的是( )| A. | 用酒精萃取碘水中的碘 | B. | 用托盘天平称取5.20 g氯化钠 | ||
| C. | 用100 mL量筒量取5.2mL盐酸 | D. | 用蒸馏可以除去水中的Fe3+等杂质 |
分析 A.酒精与水互溶,不能用酒精萃取碘水中的碘单质;
B.托盘天平的最小读数为0.1g;
C.量筒10mL以下的溶液,应该用规格为10mL的量筒;
D.pH=3.7时氢氧化铁完全沉淀.
解答 解:A.酒精易溶于水,不能用酒精萃取碘水中的碘,故A错误;
B.托盘天平只能读到0.1g,不能用托盘天平称取5.20g氯化钠,故B错误;
C.量取5.2mL的盐酸时应该选用10mL量筒,若用100mL量筒会产生较大误差,故C错误;
D.溶液pH≥3.7时,铁离子完全转化成氢氧化铁沉淀,所以可蒸馏可以除去水中的Fe3+等杂质,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及萃取、托盘天平、量筒的使用方法、物质的除杂等知识,明确化学实验基本操作方法为解答关键,试题培养了学生的化学实验能力.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
2.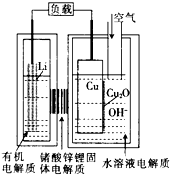 正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
 正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 通空气时,铜被腐蚀,表面产生CuO | |
| B. | 放电一段时间后右侧水溶液电解质中LiOH浓度逐渐增大 | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂 |
3.NCl3的电子式为 ,则NCl3与H2O反应时.最初的生成物一定有( )
,则NCl3与H2O反应时.最初的生成物一定有( )
 ,则NCl3与H2O反应时.最初的生成物一定有( )
,则NCl3与H2O反应时.最初的生成物一定有( )| A. | NH3 | B. | HNO2 | C. | HClO | D. | NH4Cl |
17.5.0g金属混合物与足量稀盐酸反应,收集到2.8LH2(标准状况),这种混合物可能的组成是( )
| A. | Fe和Zn | B. | Mg和Al | C. | Fe、Cu、Zn | D. | Mg、Fe、Cu |
7.下列离子方程式正确的是( )
| A. | MgCl2溶液中滴加氨水:Mg2++2OH-=Mg(OH)2↓ | |
| B. | 醋酸和氢氧化钠溶液反应:H++OH-=H2O | |
| C. | 铝和氢氧化钠溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| D. | 铁和氯化铁溶液反应:Fe+Fe3+=2Fe2+ |
14.关于FeCl3进行的实验,下列预测正确的是( )
| A. | 蒸发FeCl3溶液,得到FeCl3固体 | |
| B. | 在FeCl3、CuCl2混合液中,加入少量Fe粉,一定有H2产生且有Cu析出 | |
| C. | 用FeCl3固体溶于水配制饱和溶液,会有Fe(OH)3沉淀产生 | |
| D. | 在FeCl3溶液中,加入KHCO3溶液,有CO2产生,但无Fe(OH)3沉淀生成 |