题目内容
19.合理饮食、正确用药,有利于身体健康.
①人类的生命活动不可缺少维生素,缺乏维生素C易患坏血病病.鸡蛋中的蛋白质在人体内水解的最终产物为氨基酸,氨基酸的结构可表示为
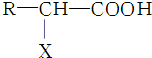 ,X的名称为氨基.
,X的名称为氨基.②阿司匹林泡腾片常用于治疗感冒引起的发热.右图为某阿司匹林泡腾片说明书的部分内容.泡腾片溶于水时产生“沸腾”效果,是由于其中含有的无水枸橼酸和碳酸钙反应释放出了气体.阿司匹林(
 )易水解,其水解反应的产物为乙酸和
)易水解,其水解反应的产物为乙酸和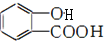 (填结构简式).
(填结构简式).③在阿司匹林、三硅酸镁、碳酸氢钠片、青霉素这四种常见的药物中,能用于抗菌消炎的是青霉素.
分析 ①人体缺乏维生素易患坏血病;氨基酸中既含氨基又含羧基;
②无水枸橼酸呈酸性,能和碳酸盐反应放出二氧化碳;阿司匹林属于酯类,故能水解;
③阿司匹林能解热镇痛;三硅酸镁能治疗胃溃疡;碳酸氢钠能治疗胃酸过多;青霉素能抗菌消炎.
解答 解:①人体缺乏维生素易患坏血病;氨基酸中既含氨基又含羧基,而此氨基酸结构中的-R为烃基,故-X为氨基,
故答案为:坏血病;氨基;
②无水枸橼酸呈酸性,能和碳酸盐反应放出二氧化碳,故泡腾片溶于水时产生“沸腾”效果,是由于其中含有的无水枸橼酸和碳酸钙反应释放出的二氧化碳气体;阿司匹林属于酯类,故能水解,且由于其是乙酸和邻羟基苯甲酸形成的酯,故其水解为乙酸和邻羟基苯甲酸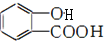 ,
,
故答案为:碳酸钙;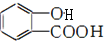 ;
;
③阿司匹林能解热镇痛;三硅酸镁能治疗胃溃疡;碳酸氢钠能治疗胃酸过多;青霉素能抗菌消炎,故能用于抗菌消炎的是青霉素,故答案为:青霉素.
点评 本题考查了维生素在人体内的重要的功能以及酯类的水解产物的分析和药物的功能,难度不大,应注意基础的掌握.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
9.硅单质及其化合物应用范围很广.请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅.四氯甲硅烷(SiCl4)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiCl4制备高纯硅的化学反应方程式SiCl2+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl.
②整个制备过程必须严格控制无水无氧.SiCl4遇水剧烈反应生成H2SiO3和另一种物质,写出配平的化学反应方程式SiCl4+3H2O═H2SiO3↓+4HCl↑.
③为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需依次加入的试剂顺序是db.(填写字母代号)
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
(2)下列有头硅材料的说法不正确的是C(填字母).
A.碳化硅化学性质稳定、硬度大,可用于砂纸、砂轮的磨料
B.含4%硅的硅钢具有很高的导磁性,可用作变压器铁芯
C.硅橡胶保持良好的弹性,耐高温但不耐低温.
D.人造分子筛是一种硅酸盐,用作吸附剂和催化剂.
(3)硅酸钠水溶液俗称水玻璃,是一种防腐剂、防火剂和矿物胶.某同学为了证明Na2SiO3具有防火性能,做如下实验:取两个相同的小木条,分别放入蒸馏水和Na2SiO3饱和溶液中,使之充分吸湿、浸透,取出稍沥干(不再滴液)后,同时分别放置在酒精灯外焰处.观察到的现象如右表:设计实验①的目的是与实验②作对照,证明起防火作用的是Na2SiO3而不是水.
(1)制备硅半导体材料必须先得到高纯硅.四氯甲硅烷(SiCl4)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiCl4制备高纯硅的化学反应方程式SiCl2+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl.
②整个制备过程必须严格控制无水无氧.SiCl4遇水剧烈反应生成H2SiO3和另一种物质,写出配平的化学反应方程式SiCl4+3H2O═H2SiO3↓+4HCl↑.
③为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需依次加入的试剂顺序是db.(填写字母代号)
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
(2)下列有头硅材料的说法不正确的是C(填字母).
A.碳化硅化学性质稳定、硬度大,可用于砂纸、砂轮的磨料
B.含4%硅的硅钢具有很高的导磁性,可用作变压器铁芯
C.硅橡胶保持良好的弹性,耐高温但不耐低温.
D.人造分子筛是一种硅酸盐,用作吸附剂和催化剂.
| 编号 | 实验 | 现象 |
| ① | 放入蒸馏水 | 木条燃烧 |
| ② | 放入Na2SiO3饱和溶液 | 木条不燃烧 |
7.下列关于化学用语叙述正确的是( )
| A. | H2O2的电子: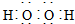 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | S2-离子的结构示意图: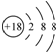 | |
| D. | FeSO4的电离方程式:FeSO4═Fe3++SO42- |
14.某水溶液中可能含有Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-离子中的若干种.某同学取200mL该溶液分成两等份依次进行如下实验:①向第一份溶液中加过量的NaOH溶液后加热,充分反应后生成0.02mol气体,无沉淀产生,同时得到溶液甲.②向溶液甲中通入过量的CO2气,充分反应生成白色沉淀,沉淀经过滤、洗涤、灼烧至恒重得到1.02g固体.③向第二份溶液中加入足量的BaCl2溶液,充分反应生成白色沉淀,沉淀用盐酸充分洗涤、干燥,得到11.65g固体.据此,该同学得到的结论正确的是( )
| A. | 实验①中产生的气体为氨,并可得原溶液中c(NH4+)=0.1 mol•L-1 | |
| B. | 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2 | |
| C. | 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证 | |
| D. | 原溶液中一定含有Na+,且c(Na+)≥0.2 mol•L-1 |
11.下列操作或装置能达到实验目的是( )
| A. | 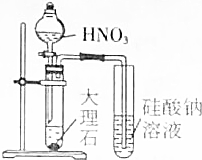 证明HNO3酸性比H2CO3强 | B. | 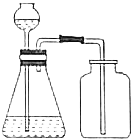 实验室用二氧化锰和盐酸制氯气 | ||
| C. | 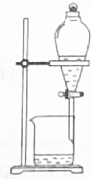 分离溴苯和苯 | D. | 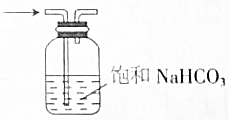 除去CO2中SO2 |
8.氧化还原反应在生活中普遍存在,下列事实中不涉及氧化还原反应的是( )
| A. | 金属锈蚀 | B. | 烟花燃放 | C. | 食物腐败 | D. | 水垢形成 |