题目内容
12.现有540g质量分数为10%的CuCl2溶液0.5L.计算(1)溶液中的CuCl2物质的量;
(2)溶液中Cu2+和Cl-的物质的量;
(3)溶液中CuCl2的物质的量浓度.
分析 (1)根据m(溶质)=m(溶液)×ω(溶质)计算CuCl2的质量,再根据n=$\frac{m}{M}$计算CuCl2的物质的量;
(2)CuCl2完全电离:CuCl2=Cu2++2Cl-的,溶液中n(Cu2+)=n(CuCl2)、n(Cl-)=2n(CuCl2);
(3)根据c=$\frac{n}{V}$计算CuCl2的物质的量浓度.
解答 解:(1)CuCl2的质量=540g×10%=54g,CuCl2的物质的量=$\frac{54g}{135g/mol}$=0.4mol,
答:溶液中CuCl2的物质的量为0.4mol;
(2)溶液中n(Cu2+)=n(CuCl2)=0.4mol、n(Cl-)=2n(CuCl2)=0.4ol×2=0.8mol,
答:溶液中Cu2+的物质的量为0.4mol、Cl-的物质的量为0.8mol;
(3)CuCl2的物质的量浓度=$\frac{0.4mol}{0.5L}$=0.8mol/L,
答:溶液中CuCl2的物质的量浓度为0.8mol/L.
点评 本题考查溶液浓度计算,为高频考点,侧重于学生的分析、计算能力的熬成,题目涉及质量分数、物质的量浓度,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
3.某元素的最外层有 2 个电子,该元素( )
| A. | 一定是金属元素 | B. | 一定是稀有气体 | ||
| C. | 一定是ⅡA 族元素 | D. | 无法确定属于哪类元素 |
7.健康是人类永恒的主题.下列有关的叙述中正确的是( )
①蛋白质和糖类都是由碳、氢、氧元素组成的;
②铁是血红蛋白的成分,能帮助运输氧气,缺铁会患坏血病;
③淀粉、蛋白质、油脂都是有机高分子化合物;
④维生素有20多种,它们多数在人体内不能合成;
⑤蔬菜、水果和粗粮等都含有较多的纤维素.
①蛋白质和糖类都是由碳、氢、氧元素组成的;
②铁是血红蛋白的成分,能帮助运输氧气,缺铁会患坏血病;
③淀粉、蛋白质、油脂都是有机高分子化合物;
④维生素有20多种,它们多数在人体内不能合成;
⑤蔬菜、水果和粗粮等都含有较多的纤维素.
| A. | ①②③④ | B. | 只有②④⑤ | C. | 只有④⑤ | D. | 只有②③⑤ |
1.下列分散系不属于胶体的是( )
| A. | 淀粉溶液 | B. | 雾 | C. | 牛奶 | D. | 碘酒 |
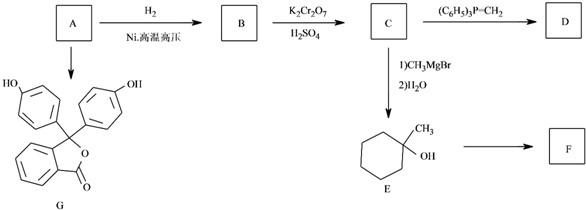
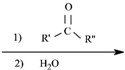
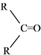 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
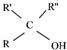
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$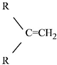 (R表示烃基,R′和R″表示烃基或基)
(R表示烃基,R′和R″表示烃基或基) .
. 、
、 .
. .
.