题目内容
现有A、B、C、D、E五种元素,其原子序数依次增大.其中由A元素组成的单质是密度最小的气体,B是空气中含量最多的元素,C是地壳中含量最多的元素,D、E组成的化合物是海水中含量最多的溶质,其离子半径E>D.
回答下列问题:
(1)由A、B、E三种元素形成的化学肥料X的化学式为 ,由A、C、D组成的化合物Y的化学式为 ,由X和Y相互反应可制取一种常见的气体Z,其反应方程式为 ;
(2)W和Z具有相同的元素组成,但W比Z中元素A的含量低,元素B和C组成的化合物Q在常温下为气体,1mol气体Q可以分解生成2mol某红棕色气体.液态W在足量的液态Q中完全燃烧,生成气态水和一种无污染的气体,试写出该反应的热化学方程式: ;
(3)由A、B、C形成的某固体化合物2.00g,在215℃时将其加热,分解成两种产物:一种为气体氧化物,另一种是0.90g的水蒸气.在标准状况下,气体混合物的总体积为1.68L.
①试计算推断该气体氧化物的化学式和该固体化合物的化学式 、
②写出215℃时固体化合物分解的化学方程式,并标明电子转移方向和数目 .
回答下列问题:
(1)由A、B、E三种元素形成的化学肥料X的化学式为
(2)W和Z具有相同的元素组成,但W比Z中元素A的含量低,元素B和C组成的化合物Q在常温下为气体,1mol气体Q可以分解生成2mol某红棕色气体.液态W在足量的液态Q中完全燃烧,生成气态水和一种无污染的气体,试写出该反应的热化学方程式:
(3)由A、B、C形成的某固体化合物2.00g,在215℃时将其加热,分解成两种产物:一种为气体氧化物,另一种是0.90g的水蒸气.在标准状况下,气体混合物的总体积为1.68L.
①试计算推断该气体氧化物的化学式和该固体化合物的化学式
②写出215℃时固体化合物分解的化学方程式,并标明电子转移方向和数目
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C、D、E五种元素,其原子序数依次增大,由A元素组成的单质是密度最小的气体,则A是H元素;B是空气中含量最多的元素,则B是N元素;C是地壳中含量最多的元素,则C是O元素;
D、E组成的化合物是海水中含量最多的溶质,为NaCl,其离子半径E>D,则D是Na、E是Cl元素;
(1)由H、N、Cl三种元素形成的化学肥料X为氯化铵,由H、O、Na组成的化合物Y是氢氧化钠,由氯化铵和NaOH反应生成氨气,所以Z是NH3;
(2)W和Z具有相同的元素组成,但W比Z中元素A的含量低,则W为N2H4;元素N和O组成的化合物Q在常温下为气体,1mol气体Q可以分解生成2mol某红棕色气体,则Q是N2O4;液态N2H4在足量的液态N2O4中完全燃烧,生成气态水和一种无污染的气体,根据元素守恒及物质性质知,生成的另一种气体是N2;
(3)由H、N、O形成的某固体化合物2.00g,在215℃时将其加热,分解成两种产物:一种为气体氧化物,另一种是0.90g的水蒸气,n(H2O)=
=0.05mol,在标准状况下,气体混合物的总体积为1.68L,气体的物质的量=
=0.075mol,则气体氧化物的物质的量为0.025mol,其质量为2.00g-0.90g=1.10g,该气体氧化物的摩尔质量=
=44g/mol,据此判断氧化物化学式,根据原子守恒确定固体化合物的化学式.
D、E组成的化合物是海水中含量最多的溶质,为NaCl,其离子半径E>D,则D是Na、E是Cl元素;
(1)由H、N、Cl三种元素形成的化学肥料X为氯化铵,由H、O、Na组成的化合物Y是氢氧化钠,由氯化铵和NaOH反应生成氨气,所以Z是NH3;
(2)W和Z具有相同的元素组成,但W比Z中元素A的含量低,则W为N2H4;元素N和O组成的化合物Q在常温下为气体,1mol气体Q可以分解生成2mol某红棕色气体,则Q是N2O4;液态N2H4在足量的液态N2O4中完全燃烧,生成气态水和一种无污染的气体,根据元素守恒及物质性质知,生成的另一种气体是N2;
(3)由H、N、O形成的某固体化合物2.00g,在215℃时将其加热,分解成两种产物:一种为气体氧化物,另一种是0.90g的水蒸气,n(H2O)=
| 0.90g |
| 18g/mol |
| 1.68L |
| 22.4L/mol |
| 1.10g |
| 0.025mol |
解答:
解:A、B、C、D、E五种元素,其原子序数依次增大,由A元素组成的单质是密度最小的气体,则A是H元素;B是空气中含量最多的元素,则B是N元素;C是地壳中含量最多的元素,则C是O元素;
D、E组成的化合物是海水中含量最多的溶质,为NaCl,其离子半径E>D,则D是Na、E是Cl元素;
(1)由H、N、Cl三种元素形成的化学肥料X为NH4Cl,由H、O、Na组成的化合物Y是NaOH,由氯化铵和NaOH反应生成氨气,所以Z是NH3,反应方程式为NH4Cl+NaOH
NaCl+NH3↑+H2O,
故答案为:NH4Cl;NaOH;NH4Cl+NaOH
NaCl+NH3↑+H2O;
(2)W和Z具有相同的元素组成,但W比Z中元素A的含量低,则W为N2H4;元素N和O组成的化合物Q在常温下为气体,1mol气体Q可以分解生成2mol某红棕色气体,则Q是N2O4;液态N2H4在足量的液态N2O4中完全燃烧,生成气态水和一种无污染的气体,根据元素守恒及物质性质知,生成的另一种气体是N2,其热化学方程式为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H<0,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H<0;
(3)由H、N、O形成的某固体化合物2.00g,在215℃时将其加热,分解成两种产物:一种为气体氧化物,另一种是0.90g的水蒸气,n(H2O)=
=0.05mol,在标准状况下,气体混合物的总体积为1.68L,气体的物质的量=
=0.075mol,则气体氧化物的物质的量为0.025mol,其质量为2.00g-0.90g=1.10g,该气体氧化物的摩尔质量=
=44g/mol,
①氮的氧化物摩尔质量为44g/mol的是N2O,n(H2O):n(N2O)=0.05mol:0.025mol=2:1,根据原子守恒知,该固体物质化学式为NH4NO3,
故答案为:N2O;NH4NO3;
②该反应方程式为NH4NO3
2H2O+N2O,该反应中N元素化合价由-3价、+5价变为+1价,转移电子数是4,电子转移方向和数目为 ,故答案为:
,故答案为: .
.
D、E组成的化合物是海水中含量最多的溶质,为NaCl,其离子半径E>D,则D是Na、E是Cl元素;
(1)由H、N、Cl三种元素形成的化学肥料X为NH4Cl,由H、O、Na组成的化合物Y是NaOH,由氯化铵和NaOH反应生成氨气,所以Z是NH3,反应方程式为NH4Cl+NaOH
| ||
故答案为:NH4Cl;NaOH;NH4Cl+NaOH
| ||
(2)W和Z具有相同的元素组成,但W比Z中元素A的含量低,则W为N2H4;元素N和O组成的化合物Q在常温下为气体,1mol气体Q可以分解生成2mol某红棕色气体,则Q是N2O4;液态N2H4在足量的液态N2O4中完全燃烧,生成气态水和一种无污染的气体,根据元素守恒及物质性质知,生成的另一种气体是N2,其热化学方程式为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H<0,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H<0;
(3)由H、N、O形成的某固体化合物2.00g,在215℃时将其加热,分解成两种产物:一种为气体氧化物,另一种是0.90g的水蒸气,n(H2O)=
| 0.90g |
| 18g/mol |
| 1.68L |
| 22.4L/mol |
| 1.10g |
| 0.025mol |
①氮的氧化物摩尔质量为44g/mol的是N2O,n(H2O):n(N2O)=0.05mol:0.025mol=2:1,根据原子守恒知,该固体物质化学式为NH4NO3,
故答案为:N2O;NH4NO3;
②该反应方程式为NH4NO3
| ||
 ,故答案为:
,故答案为: .
.
点评:本题考查位置结构性质相互关系及应用,涉及氧化还原反应、热化学方程式的书写、氨气的制取等知识点,侧重考查分析、计算能力,难点是(3)中化学式的确定,难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目

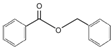 )可用于治疗疥螨,抗寄生虫,也可作麝香定香剂及樟脑代用品等.合成苯甲酸苄酯的方法有多种,下列路线是其中的两种合成方法:
)可用于治疗疥螨,抗寄生虫,也可作麝香定香剂及樟脑代用品等.合成苯甲酸苄酯的方法有多种,下列路线是其中的两种合成方法:
 的路线如下:
的路线如下:








 ,则X的结构简式为
,则X的结构简式为