题目内容
6.在①丙烯 ②氟苯 ③四氯乙烯 ④甲苯四种有机化合物中,分子内所有原子均在同一平面的是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
分析 常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断,注意单键可以旋转,以此解答该题.
解答 解:①丙烯CH2=CH-CH3中有一个甲基,甲基具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故①错误;
②苯是平面结构,氟苯看作是一个氟原子取代苯中的一个氢原子,所有原子在同一个平面,故②正确;
③乙烯具有平面型结构,四氯乙烯看作是一个氯原子取代乙烯中的氢原子,所有原子在同一个平面,故③正确;
④甲苯中含有一个甲基,甲基具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故④错误;
故选B.
点评 本题主要考查有机化合物的结构特点,为高频考点,侧重于学生的分析能力的考查,做题时注意从甲烷、乙烯、苯的结构特点判断有机分子的空间结构,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
7.ωg铁粉和铝粉的混合物,与过量的NaOH溶液反应,然后过滤,将沉淀放在蒸发皿中加热,充分反应后,所得固体物质的质量仍为ωg.则原混合物中铝粉的质量分数是( )
| A. | 30% | B. | 50% | C. | 70% | D. | 90% |
5.由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如图,下列说法正确的是( )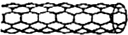

| A. | 纳米碳管是一种无机化合物 | |
| B. | 0.12g纳米碳管中含有6.02×l022个碳原子 | |
| C. | 纳米碳管与石墨互为同位素 | |
| D. | 纳米碳管中碳原子间以共价键结合 |
1.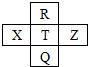 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
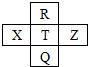 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )| A. | 非金属性:X<T<Z | B. | 第一电离能:Z<X<T | ||
| C. | 最高价氧化物的水化物酸性:Q<T<R | D. | 气态氢化物的还原性:R<T<X |
11.2,3-二甲基丁烷可生成多少种不同沸点的一溴代物( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
18.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 | |
| D. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16族 |
15.标准状况下,将NO2、NO、O2 混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器中HNO3溶液的物质的量的浓度(mol/L)用M表示范围是( )
| A. | $\frac{1}{28}$<M<$\frac{1}{22.4}$ | B. | $\frac{1}{39.2}$<M<$\frac{1}{22.4}$ | C. | $\frac{1}{39.2}$<M<$\frac{1}{28}$ | D. | 0<M<$\frac{1}{22.4}$ |
16.现有核电荷数小于20的元素A,其电离能数据如下:(I1表示失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:×102 kJ•mol-1)
(1)外层电子离核越远,能量越高,电离能越小(填“大”或“小”);阳离子电荷数越高,失去电子时,电离能越大(填“大”或“小”).
(2)上述11个电子分属3个电子层.
(3)失去了11个电子后,该元素还有1个电子.
(4)该元素最高价氧化物对应水化物的化学式是Mg(OH)2.
| 序号 | I1 | I2 | I3 | I4 | I5 | I6 |
| 电力能 | 7.644 | 15.03 | 80.12 | 109.3 | 141.2 | 186.5 |
| 序号 | I7 | I8 | I9 | I10 | I11 | … |
| 电力能 | 224.9 | 266.0 | 327.9 | 367.4 | 1761 | … |
(2)上述11个电子分属3个电子层.
(3)失去了11个电子后,该元素还有1个电子.
(4)该元素最高价氧化物对应水化物的化学式是Mg(OH)2.