题目内容
18.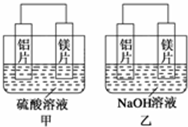 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.(1)写出甲中正极的电极反应式2H++2e-═H2↑.
(2)乙中总反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出Mg活动性更强,而乙会判断出Al活动性更强.(填写元素符号)
(4)由此实验得出的下列结论中,正确的有AD.
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,应具体问题具体分析.
分析 (1)在酸性介质中镁比铝活泼,所以甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;
(2)在碱性介质中铝比镁活泼,所以乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;
(3)原电池中负极失电子金属的活泼性强;
(4)A.原电池正负极与电解质溶液有关;
B.镁的金属性大于铝;
C.该实验证明说明电解质溶液性质选用选择合适的介质,不能说明金属活动性顺序过时;
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析.
解答 解:(1)镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,原电池中阴离子向负极移动,所以硫酸根离子流向镁片,正极的电极反应式为:2H++2e-=H2↑;
故答案为:2H++2e-=H2↑;
(2)在碱性介质中铝比镁活泼,所以乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应,总的电极反应式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)原电池中负极失电子金属的活泼性强,甲中Mg失电子作负极,Mg的活泼性强,乙中Al失电子作负极,Al的活泼性强;
故答案为:Mg;Al;
(4)A.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故A正确;
B.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故B错误;
C.该实验说明电解质溶液性质影响电极的正负极,不能说明金属活动性顺序没有使用价值,故C错误;
D.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故D正确;
故答案为:AD.
点评 本题考查了探究原电池原理,题目难度中等,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极,为易错点.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. | 将溴乙烷与NaOH溶液共热几分钟后,冷却、滴加AgNO3溶液,验证产物Br- | |
| B. | 在溴化铁的催化下苯与浓溴水反应制取溴苯 | |
| C. | 石油在常压下分馏可得到石蜡 | |
| D. | 乙烯通入到酸性KMnO4溶液使之褪色 |
| A. | Fe和盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 石灰石和盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| A. | X和Y的总能量一定低于M和N的总能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X的能量一定低于M的,Y的能量一定低于N的 |
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. |  2-甲基丁烯 2-甲基丁烯 | D. |  苯甲醇 苯甲醇 |
| A. | CO2 | B. | SO2 | C. | NO2 | D. | PM2.5 |

请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:②除去反应生成的氯气,有利于反应正反应方向进行
(请从化学平衡角度解释).
(3)已知几种物质的溶解度见下表:
| KCl | KH(IO3)2 | KClO3 | |
| 溶解度g/100g水(25℃) | 20.8 | 0.8 | 7.5 |
| 溶解度g/100g水(80℃) | 37.1 | 12.4 | 16.2 |
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是使KH(IO3)2转化为KIO3.
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0mol•L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00mL,则成品中KIO3的质量分数为85.6%(列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,I2+2Na2S2O3═2NaI+Na2S4O6).
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
②根据乙同学的实验结果推测,甲同学的实验结果会偏大(填“偏大”,“偏小”或“无影响”).
| A. | CO2与SO2 | B. | CH4与NH3 | C. | SO3与BF3 | D. | H2S与CCl4 |
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5 NA | |
| B. | 26g乙炔所含共价键数目为2 NA | |
| C. | 标准状况下,11.2 L CCl4所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |